
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________。
(2)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=__________,联氨和N2O4可作为火箭推进剂的主要原因为______________。
(3)联氨为二元弱碱,在水中的电离方式与氨相似,联氨第一步电离方程式为:_________________。
【答案】(1)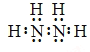 ;
;
(2)2ΔH3-2ΔH2-ΔH1 ;反应放热量大、产生大量气体
(3)N2H4 + H2O ![]() N2H5+ + OH-
N2H5+ + OH-
【解析】
试题分析:(1)肼的分子式为N2H4,是氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)①2O2(g)+N2(g)═N2O4(l)△H1,②N2(g)+2H2(g)═N2H4(l)△H2,③O2(g)+2H2(g)═2H2O(g)△H3,依据热化学方程式和盖斯定律计算③×2-②×2-①得到④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=2△H3-2△H2-△H1,根据反应④可知,联氨和N2O4反应放出大量热且产生大量气体,因此可作为火箭推进剂,故答案为:2△H3-2△H2-△H1;反应放热量大,产生大量气体;
(3)联氨在水中的电离方式与氨相似,联氨第一步电离方程式为N2H4 + H2O ![]() N2H5+ + OH-,故答案为:N2H4 + H2O
N2H5+ + OH-,故答案为:N2H4 + H2O ![]() N2H5+ + OH-。
N2H5+ + OH-。


科目:高中化学 来源: 题型:
【题目】实验室里用下列仪器和药品制取纯净的无水氯化铜。根据要求完成以下问题:

(1)按气体从左向右流动,装置②在④左边,则②中加入的液体是 ;
(2)装置⑤中发生反应的化学方程式是 ;
(3)实验开始时,应先点燃 (填装置序号)处的酒精灯,否则CuCl2中含有 (填化学式)杂质。待充分反应后,装置①的玻璃管中剩余物呈 色;
(4)某实验小组组装装置时,在①和⑥之间添加了一个盛有浓硫酸的洗气瓶,其作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672 mL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A.504 mL B.168 mL C.224mL D.336 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下图所示:

对上述流程中的判断正确的是( )
①试剂X为稀硫酸,沉淀中含有硅的化合物
②反应 II 中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-
③结合质子(H+) 的能力由弱到强的顺序是OH->AlO2->CO32-
④Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
A. ①② B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通玻璃的主要成分是:
①Na2SiO3 ②CaCO3 ③CaSiO3 ④SiO2 ⑤Na2CO3 ⑥CaO
A. ①③⑥ B. ②③④ C. ①③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:

(1)已知:2Cu (s)+O2(g) =Cu2O(s) △H=-a kJ·mol-1
C (s)+O2(g) =CO (g) △H=-b kJ·mol-1
Cu (s)+O2(g) =CuO (s) △H=-c kJ·mol-1
则方法I发生的反应:2CuO(s) +C(s) =Cu2O(s)+CO(g);△H__________kJ·mol-1
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:__________________。
(3)方法II为加热条件下用液态肼(N2H4)逐原新制Cu (OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为____________________。
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式并说明该装置制备Cu2O的原理________________________。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g) ![]() 2H2(g) + O2(g) △H>O,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示
2H2(g) + O2(g) △H>O,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示

下列叙述正确的是_________(填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10- 5mol/(L·min)
c.实验②比实验①所用的Cu2O催化效率高
d.实验①、②、③的化学平衡常数的关系:K1=K2<K3

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生态农业涉及农家肥料的综合利用。某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体8.96L(标准状况)。该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO ![]() CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L0.lmol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。求:
CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L0.lmol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。求:
(1)原混合气体中甲烷的体积(标准状况)(写出计算过程)
(2)反应后的气体中CO2的物质的量可能为___________
(3)原混合气体中氮气的体积为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研、生产和生活中的下列做法,利用了氧化还原反应的是
A.用乙醚从黄花蒿中提取青蒿素
B.用氯化铁溶液腐蚀铜制印刷电路板
C.空气净化器中用活性炭层净化空气
D.用热的纯碱溶液去除油污
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com