
| ||
 (浓)═MnCl2+Cl2↑+2H2O可看出每生成1mol氯气转移的电子数为2mol,所以产生0.5mol氯气将会转移1mol电子.
(浓)═MnCl2+Cl2↑+2H2O可看出每生成1mol氯气转移的电子数为2mol,所以产生0.5mol氯气将会转移1mol电子.
| ||
 (浓)═MnCl2+Cl2↑+2H2O,
(浓)═MnCl2+Cl2↑+2H2O, (浓)═MnCl2+Cl2↑+2H2O.
(浓)═MnCl2+Cl2↑+2H2O. (浓)═MnCl2+Cl2↑+2H2O可看出每生成1mol氯气转移的电子数为2mol,所以产生0.5mol氯气将会转移1mol电子.
(浓)═MnCl2+Cl2↑+2H2O可看出每生成1mol氯气转移的电子数为2mol,所以产生0.5mol氯气将会转移1mol电子.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
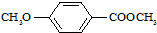
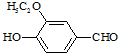 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.| CrO3/H2SO4 |
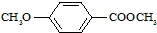 )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛( 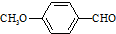 )合成X.用反应流程图表示如下:
)合成X.用反应流程图表示如下: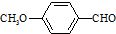 →
→
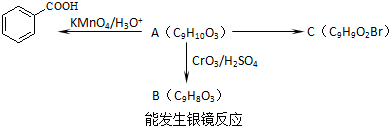
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3?H2O) |
| B、某溶液中只存在Cl-、OH、NH4+、H+四种离子,则一定不存在下列关系:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C、将0.2 mol?L-1的某一元酸HA溶液和0.1 mol?L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:2c(OH-)+c(A-)=2c(H+)+c(HA) |
| D、某物质的溶液中由水电离出的c(H+)=1×10-amol?L-1,则溶液的pH一定为14-a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水中:NH4+、Fe2+、SO42-、HSO3- |
| B、pH=l的溶液中:Mg2+、Fe3+、Cl-、NO3- |
| C、通入足量CO2的溶液中:Ca2+、Na+、CO32-、SiO32- |
| D、水电离产生的c(H+)=1×10-14 mol?L-1的溶液中:Al3+、K+、Cl、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、被氧化的砒霜为1.98 g |
| B、分解产生的氢气为672 mL |
| C、和砒霜反应的锌为3.90 g |
| D、转移的电子总数为0.06NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | T(℃) |
| P(MPa) | ||
| 1 | 150 |
| 0.1 | ||
| 2 | a |
| 5 | ||
| 3 | 350 | b | 5 |
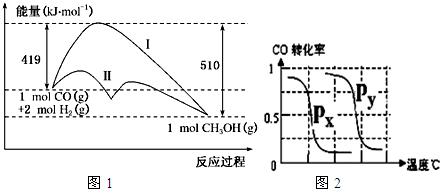
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CCl2I2分子是非极性分子 |
| B、CCl2I2分子含有π键 |
| C、CCl2I2分子是手性分子 |
| D、CCl2I2的沸点高于CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用25mL碱式滴定管量取18.0mL KMnO4溶液 |
| B、在含有FeC12杂质的FeC13溶液中通入足量C12后,充分加热,即可得到纯净的FeC13溶液 |
| C、使用湿润的pH试纸测定气体的酸碱性 |
| D、为减小中和滴定误差,锥形必须用待测液润洗后才能使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com