
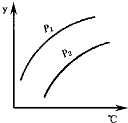
 如图表示不同温度和压强下,对可逆反应2L(气)?2M(气)+N(气)△H>0平衡状态的影响(p1<p2),图中y轴表示的意义是( )
如图表示不同温度和压强下,对可逆反应2L(气)?2M(气)+N(气)△H>0平衡状态的影响(p1<p2),图中y轴表示的意义是( )| A. | 一定条件下L的转化率 | B. | 气体混合物的平均摩尔质量 | ||
| C. | 气体混合物中L的体积分数 | D. | 气体L的物质的量 |
分析 由图可知,压强越大,Y的值的越小,温度越高,Y的值越大,而反应为气体体积增大的吸热反应,根据外界条件对平衡移动的影响答题.
解答 解:由图可知,压强越大,Y的值的越小,温度越高,Y的值越大,而反应为气体体积增大的吸热反应,则
A、压强增大,平衡逆向移动,L的转化率减小,升高温度平衡正向移动L的转化率增大,故A正确;
B、该反应气体质量守恒,压强增大,平衡逆向移动,总物质的量减小,平均相对分子质量增大,温度升高,平衡正向移动,总物质的量增大,平均相对分子质量减小,故B错误;
C、压强增大,平衡逆向移动,L的体积分数增大,故C错误;
D、压强增大,平衡逆向移动,L的物质的量增大,故D错误;
故选A.
点评 本题主要考查了外界条件对平衡移动的影响,中等难度,解题时注意图与反应的特征相结合.


科目:高中化学 来源: 题型:选择题
| A. | 分子数相同 | B. | 氧原子个数相等 | C. | 氢原子个数相等 | D. | 质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液中水的电离程度小于Na2SO3 溶液,也小于Na2SO4 溶液 | |
| B. | [HSO3-]>[SO32-]>[H2SO3 ] | |
| C. | 该溶液中由水电离出的[H+]为1×10-4mol/L | |
| D. | 加入少量NaOH使溶液的pH升高会使水的电离受到抑制 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用高锰酸钾溶液滴定Na2SO3溶液至终点,滴入最后一滴高锰酸钾溶液,溶液颜色恰好由紫红色变为无色且半分钟不变色 | |
| B. | 燃料电池制作的实验中,石墨棒用海绵包裹是为了更好的固定电极 | |
| C. | pH试纸在检测溶液时不能湿润,使用石蕊试纸检测气体时需要湿润并粘在洁净玻璃棒的一端 | |
| D. | 海带中提取碘,可将灰化后的海带加水煮沸一段时间后过滤,在滤液中加入稀硫酸后转移到分液漏斗中用CCl4萃取分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学课外活动小组设计如下图实验装置,完成探究某些物质的性质和比较性质强弱的实验.
某校化学课外活动小组设计如下图实验装置,完成探究某些物质的性质和比较性质强弱的实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 436kJ | B. | 557kJ | C. | 872kJ | D. | 181kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com