
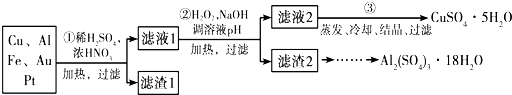

分析 (1)工业上主要用热还原法来炼铁;
(2)第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染;
(3)调溶液PH的目的是使Fe3+和Al3+形成沉淀;
(4)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
解答 解:(1)工业上主要用热还原法来炼铁,故答案为:热还原法;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O,过氧化氢做氧化剂被还原后为水,不引入杂质,对环境无污染,故答案为:将Fe2+氧化为Fe3+;不引入杂质,对环境无污染;
(3)调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,
故答案为:Fe3+、Al3+;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,故不合理,故答案为:甲方案得到的硫酸铝晶体中混有大量硫酸铁杂质;
点评 本题考查制备硫酸铜和硫酸铝晶体的实验设计,明确离子的性质是解答本题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA | |
| B. | 10g46%的乙醇水溶液中所含氢原子数目为0.06NA | |
| C. | 1L1 mol•L-1的NH4NO3溶液中含有NH4+数目为NA | |
| D. | 25℃时,100mlpH=13的Ba(OH)2溶液中OH-的数目为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7g H2O2中含有的电子数为0.9 NA | |
| B. | 等物质的量的N2和CO所含分子数均为NA | |
| C. | 1mol Na2O2 固体中含离子总数为4 NA | |
| D. | 标准状况下,2.24L戊烷所含分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | O2浓度增加 | C. | O2压强不变 | D. | BaO量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol CO、1mol O2 | 2mol CO2 | 4mol CO2 |
| CO2的浓度(mol•L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出aKJ | 吸收bKJ | 吸收CkJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| A. | 2c1<c3 | B. | a+b=283.0 | C. | 2p2>p3 | D. | c1=c2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com