
常温下,0.2mol•L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度所示,下列说法正确的是( )
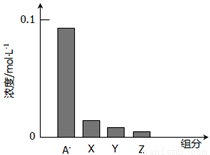
A.HA为强酸
B.该混合溶液pH=7.0
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
科目:高中化学 来源:2016届海南中学高三考前高考模拟十化学试卷(解析版) 题型:选择题
分子式为C9H18O2的有机物A,它能在酸性条件下水解生成B和C,其中C不与NaHCO3溶液反应,1 mol C完全燃烧产生的气体与足量澄清石灰水反应能生成400g沉淀。则有机物A的可能结构有(不考虑立体异构)
A.4种 B.8种
C.10种 D.16种
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前预测化学试卷(解析版) 题型:选择题
下列事实中,能说明B(OH)2是弱碱的是( )
A.等体积的0.010mol/LB(OH)2溶液与0.010mol/LH2SO4溶液恰好完全反应
B.0.010mol/LB(OH)2溶液能使红色石蕊试液变蓝
C.0.010mol/LBCl2溶液呈酸性,0.010mol/LB2CO3溶液呈中性
D.0.010mol/LB(OH)2溶液能够与NH4Cl反应生成NH3(g)
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第八次月考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.1.6gNH2-和1.5g—CH3含有的电子数均为NA
B.标准状况下,将2.24L 氯化氢溶于足量水中,溶液中含有的HCl分子数为0.1NA
C.氢氧化钠溶于与氯气反应时,生成0.1molNaCl转移的电子数为0.1NA
D.12gNaHSO4晶体中阳离子和阴离子的总数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三5月高考模拟理综化学试卷(解析版) 题型:实验题
工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
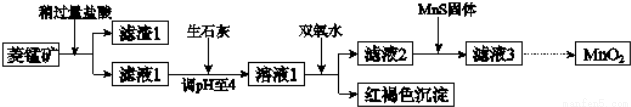
已知:1
生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
2:下表是三种难溶金属硫化物的溶度积常数(25℃)

回答下列问题:
(1)滤渣1为____________;
(2)向溶液1中加入双氧水时,反应的离子方程式是____________;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是____________;在CuS、MnS共存的悬浊液中,则c(Cu2+)/c(Mn2+)=____________。
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+□_____=□_____+□______+□______;
(5)将MnCl2转化为MnO2的另一种方法是电解法。
①生成MnO2的电极反应式是____________;
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2,检验Cl2的操作是____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:填空题
硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒。取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表。回答下列问题:
温度范围/℃ | 固体质量/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000以上 | 1.44 |
(1)测定蓝矾属于晶体的物理方法是____________。其中SO42-中S原子的轨道杂化形式是____________;H2O的空间构型是__________________。
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是__________(化学式);A溶于水配成溶液,加入氨水,观察到的现象是_____________________________________________;最终得到溶液中的含铜元素的离子是_________________(化学式),该离子含有的化学键类型有___________________。
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是____________;
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子)。

①该温度是_______________。
②铜原子的配位数是_______________。
③已知该晶体的密度为dg·cm-3,则晶胞参数是_________________pm。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:选择题
下表中的实验操作能达到实验目的的是
选项 | 实验操作 | 实验目的 |
A | 向含有KSCN溶液的FeSO4溶液中滴加硫酸酸化的H2O2溶液 | 检验H2O2的氧化性大于Fe3+ |
B | 滴入KI试液 | 检验淀粉是否已完全水解 |
C | 先滴入Ba(NO3)2溶液.产生沉淀,加入足量稀盐酸,仍有沉淀 | 检验溶液中是否含有SO42- |
D | 向乙醇溶液加入钠粒 | 测定乙醇分子中含有羟基 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:填空题
有A、B、C、D、E五种元素.其相关信息如下:

请回答下列问题。
(1)写出E元素原子基态时M层的电子排布式_____________;
(2)C元素单质分子中含有δ和π键的键数之比为_____________;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:_____________ ;C2A4分子中C原子轨道的杂化类型是_____________;
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有_____________(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为_____________(填序号).
a.平面正方形b.正四面体 c.三角锥型 d.V型
(5) 三硫化四磷是黄绿色针状结晶,其结构如图所示。三硫化四磷分子中P原子采取_____________杂化,与PO3-互为等电子体的化合物分子的化学式为_____________,用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_____________。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期中化学试卷(解析版) 题型:选择题
已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案:将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6 mol.L-1 NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片,用水冲洗、烘干后称量,质量为m2。下列说法正确的是( )
A.设锌镀层厚度为h,锌的密度为ρ,则h=(m1-m2)/( ρS)
B.锌电极的电极反应式为 2H2O + 2e- = H2 + 2OH-
H2 + 2OH-
C.锌和石墨在碱溶液中形成原电池,外电路中电流从锌流向石墨
D.当石墨上不再有气泡时,立即取出铁皮,冲洗后用酒精灯加热烘干,铁片可能部分被氧化导致实验结果偏低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com