
 用酸性氢氧燃料电池为电源电解CuSO4溶液,实验装置如图所示.下列关于此装置的说法中,正确的是( )
用酸性氢氧燃料电池为电源电解CuSO4溶液,实验装置如图所示.下列关于此装置的说法中,正确的是( )| A、燃料电池工作时,负极反应为O2+4H++4e-═2H2O |
| B、a极是石墨,b极是铜时,b极的电极反应为:4OH--4e-═2H2O+O2↑ |
| C、a极是石墨,b极是纯铜时,电解一定时间后两极产生的气体体积都为224ml(标准状况),则原溶液的浓度是0.1mol/L |
| D、a、b两极均是石墨时,若a极产生的气体为56mL(标准状况),则U形管中溶液的PH为2(体积变化忽略不计) |
| n |
| V |
| 0.056L |
| 22.4L/mol |
| 0.01mol×4-0.01mol×2 |
| 2 |
| n |
| V |
| 0.01mol |
| 0.1L |
| 0.056L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积 |
| B、晶胞中原子的配位数分别为:①6,②8,③8,④12 |
| C、金属镁采取③的堆积方式 |
| D、空间利用率的大小关系为:①<②<③<④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车排放的尾气和燃煤排放颗粒污染物是形成雾霾的重要因素 |
| B、为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| C、高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| D、“低碳”生活倡导节能减排,禁止使用化石燃料,减少污水排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
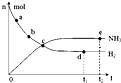 科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的正反应速率比点b的大 |
| B、点c处反应达到化学平衡状态 |
| C、点d和点e处的n(N2)不相同 |
| D、点e反应达到化学平衡状态,反应停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 熔融状态下,Na和FeCl2能组成可充电电池(装置如图所示),反应原理为:2Na+FeCl2
熔融状态下,Na和FeCl2能组成可充电电池(装置如图所示),反应原理为:2Na+FeCl2| 放电 |
| 充电 |
| A、放电时,a为正极,b为负极 |
| B、放电时,负极反应为:Fe2++2e-=Fe |
| C、充电时,a接外电源正极 |
| D、充电时,b极处发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol硫酸中含有4mol氧原子 | ||
B、1个H2SO4分子的质量约是
| ||
| C、硫酸的摩尔质量是98g | ||
| D、6.02×1023个H2SO4分子的质量约是98g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Na2O2+2H2O═4NaOH+O2↑ |
| B、Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ |
| C、CaC2+2H2O═Ca(OH)2+CH≡CH↑ |
| D、NH4Cl+NaOH═NaCl+NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的离子积就是水的电离平衡常数 |
| B、若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14 |
| C、Ksp反映了物质在水中的溶解能力,可直接根据Ksp的数值大小比较电解质在水中溶解度大小 |
| D、盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com