
| A. | ①、②、⑥分子中碳原子数小于10,③、⑤分子中碳原子数大于10 | |
| B. | ①、②是无机物,③、⑤、⑦是有机物 | |
| C. | ①、④是酸,③、⑤不是酸 | |
| D. | ②、③、④含氧元素,⑤、⑥、⑦不含氧元素 |
分析 A、根据物质的名称和含有碳原子的数目知识来回答;
B、大多数含有碳元素的化合物属于有机物;
C、能和强碱反应生成盐和水的氧化物属于酸性氧化物;
D、根据物质的组成元素来回答.
解答 解:A、①辛酸为含有8个碳原子的酸;②壬酸为含有9个碳原子的酸;⑥己醛为含有6个碳的醛,均小于10,⑤十八烷的碳原子数为18,均大于10,故A正确;
B、①辛酸;②壬酸;③环十二醇;④5,9十一烷酸内酯;⑤十八烷;⑥己醛;⑦庚醛均属于有机物,故B错误;
C、①辛酸属于有机羧酸,④乙酸乙酯属于酯类,不是羧酸,故C错误;
D、羧酸、醛、醇和酯均含有氧元素,故②、③、④、⑦、⑥含氧元素,⑤中只有C、H元素,故D错误,
故选A.
点评 本题考查学生物质的分类知识,可以根据所学知识进行回答,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 操作 | 现象 |
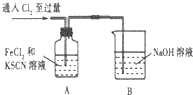 | 1.A中溶液变红 2.稍后,A中溶液由红色变为黄色 |
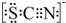 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2Y的电离方程式为:H2Y+2H2O?2H3O++Y2- | |
| B. | 在该酸式盐溶液中c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解方程式为HY-+H2O?H3O++Y2- | |
| D. | 在该酸式盐溶液中c(Na+)>c(HY-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | Fe3+ | C. | Fe3+、Cu2+ | D. | Fe2+ Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯原子的结构示意图: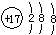 | |
| B. | 作为相对原子质量测定标准的碳核素:12C | |
| C. | 氨气(NH3)中氮元素的化合价是+3 | |
| D. | Na+的电子式:Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
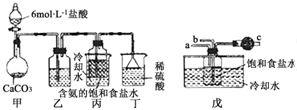 “侯氏制碱法”是我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得NaHCO3,进而生产纯碱的一种化工方法.有关的化学反应方程式如下:
“侯氏制碱法”是我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得NaHCO3,进而生产纯碱的一种化工方法.有关的化学反应方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中一定有新物质生成 | |
| B. | 化学反应中旧的化学键的断裂需要吸收热量,新的化学键的生成需要放出能量 | |
| C. | 化学反应通常需要加热等条件才能发生 | |
| D. | 能量变化是化学反应的基本特征之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com