
A.1 mol·L-1 B.3 mol·L-1 C.1.5 mol·L-1 D.3.5 mol·L-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
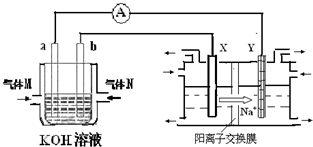 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.| 1 |
| 2 |
| 1 |
| 2 |
| 物质的量/(mol)/时间(h) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
如下图所示,在烧杯A、B中盛有20℃的水50 mL,试管C、D上端用玻璃管和橡皮管相通,试管内充满红棕色气体,它处于平衡状态:2NO2![]() N2O4(正反应放热).然后用夹子夹住橡皮管.再向A中加入50g NH4NO3,向B中加入2g NaOH,使之溶解.
N2O4(正反应放热).然后用夹子夹住橡皮管.再向A中加入50g NH4NO3,向B中加入2g NaOH,使之溶解.
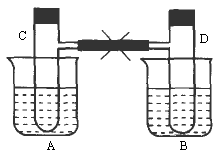
试回答下列问题:
(1)烧杯A中温度________,B中温度________.
(2)试管C中气体颜色变________,D中气体颜色变________.
(3)已知20℃时NH4NO3的溶解度为192g,则A中的溶液________达到饱和.
(4)试比较分别加NH4NO3和NaOH固体后,待气体重新达到平衡后,C、D两试管中混合气体的平均摩尔质量的关系:M(C)________M(D)(选填“大于”、“等于”或“小于”).
查看答案和解析>>
科目:高中化学 来源: 题型:022
如图为向盛有0.2 mol•L-1 50 mL明矾溶液中,慢慢加入0.1 mol•L-1 Ba(OH)2溶液,生成沉淀的质量随着加入Ba(OH)2溶液的体积变化的图像,当产生的沉淀量最大时(即B点)改加0.5 mol•L-1 HCl.沉淀总质量又发生变化(虚线部分)。

⑴写出OA、AB、C、CD四段发生反应的化学方程式。
⑵计算A、B、C、D点所加入Ba(OH)2溶液、盐酸体积及沉淀质量并填入下表。
|
|
A |
B |
|
V[Ba(OH)2]/mL |
|
|
|
m(沉淀)/g |
|
|
查看答案和解析>>
科目:高中化学 来源:专项题 题型:实验题
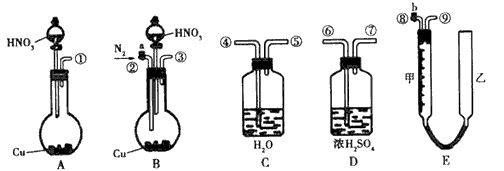
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.实验室称取0.867 g草酸钠(Na2C2O4,式量为134),溶解于水,加入一定量硫酸,用未知浓度的KMnO4溶液滴定,用去KMnO4溶液22.50 mL,反应式如下(未配平):
MnO4- + C2O42- + H+ → Mn2+ + CO2 + H2O。
则装KMnO4的滴定管是_______(填“酸式”或“碱式”); KMnO4溶液的浓度是________mol/L。
Ⅱ.某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)![]() N(g)+H2(g)
N(g)+H2(g)
| 起始n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
①该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
②结合表中数据,判断下列说法中正确的是 。
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的量之比为1:4时,M的转化率为0.85
③该温度下,向容器中充入2molM、2mol H2O ,当达平衡时放出a KJ热量,则该反应的
△H=
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com