
 A��B��C��D��EΪԭ�������������������Ԫ�أ�A��һ��ͬλ�ؿ����ڿ����вⶨ�������������� B��Aͬ���ڣ���s�ܼ���������p�ܼ��������ࣻCԭ�ӵ������������Ǵ�����3����D��Bͬ���壻E��ԭ������Ϊ29���ش��������⣺
A��B��C��D��EΪԭ�������������������Ԫ�أ�A��һ��ͬλ�ؿ����ڿ����вⶨ�������������� B��Aͬ���ڣ���s�ܼ���������p�ܼ��������ࣻCԭ�ӵ������������Ǵ�����3����D��Bͬ���壻E��ԭ������Ϊ29���ش��������⣺ ��
������ A��B��C��D��EΪԭ�������������������Ԫ�أ�A��һ��ͬλ�ؿ����ڿ����вⶨ����������������AΪ̼Ԫ�أ� B��Aͬ���ڣ���s�ܼ���������p�ܼ��������࣬ԭ�Ӻ���������Ų�ʽΪ1s22s22p3����BΪNԪ�أ�Cԭ�ӵ������������Ǵ�����3����ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����CΪOԪ�أ�D��Bͬ���壬��DΪPԪ�أ�E��ԭ������Ϊ29����EΪCu��
��1���ǽ�����Խǿ��һ������Խ��NԪ��ԭ��2p�ܼ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�صģ�
DΪPԪ�أ�ԭ�Ӽ۵����Ų�ʽΪ3s23p3���������ԭ�������ع����۵����Ų�ͼ��
��2��NH3����֮�����������е���ڼ���ģ����������Cԭ���γ�4��C-H����û�й¶Ե��ӣ��ӻ������ĿΪ4��
��3������NO3-��Nԭ�ӹµ��Ӷ������۲���Ӷ�����ȷ�������幹�ͣ�ԭ����Ŀ��ȡ��۵�������Ҳ��ȵ�����Ϊ�ȵ����壻
��4��Cu+������Χ�����Ų�Ϊ3d10��Ϊȫ���ȶ�״̬��Cu2O���ȶ��������������ԭ����дCuԭ�ӵ���Χ�����Ų�ʽ��Cu����Ķѻ���ʽΪ�����������ܶѻ���
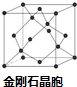
��5������P���γ�һ����ĥ����F����ṹ����ʯ���ƣ���FΪBP������������廯���D�����廯���ڸ������������ķ�Χ�кϳɣ���Ӧ������HBr������ԭ���غ���ƽ��
������ʯ������Cԭ����Ŀ������ȷ��������B��Pԭ����Ŀ����ʾ��BP�����������ٸ��ݦ�=$\frac{m}{V}$���㾧���ܶȣ�
��� �⣺A��B��C��D��EΪԭ�������������������Ԫ�أ�A��һ��ͬλ�ؿ����ڿ����вⶨ����������������AΪ̼Ԫ�أ� B��Aͬ���ڣ���s�ܼ���������p�ܼ��������࣬ԭ�Ӻ���������Ų�ʽΪ1s22s22p3����BΪNԪ�أ�Cԭ�ӵ������������Ǵ�����3����ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����CΪOԪ�أ�D��Bͬ���壬��DΪPԪ�أ�E��ԭ������Ϊ29����EΪCu��
��1���ǽ�����Խǿ��һ������Խ��NԪ��ԭ��2p�ܼ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�صģ���NԪ�صĵ�һ���������
DΪPԪ�أ�ԭ�Ӽ۵����Ų�ʽΪ3s23p3��ԭ�Ӽ۵����Ų�ͼΪ ��
��
�ʴ�Ϊ��N�� ��
��
��2��Ԫ��A��B�ļ���̬�⻯��ֱ�ΪCH4��NH3��NH3����֮�����������е���ڼ���ģ����������Cԭ���γ�4��C-H����û�й¶Ե��ӣ���̼ԭ�Ӳ�ȡsp3�ӻ���
�ʴ�Ϊ�����ڣ�NH3����֮����������sp3��
��3��NO3-��Nԭ�ӹµ��Ӷ���=$\frac{5+1-2��3}{2}$=0���۲���Ӷ���=3+0=3�����幹��Ϊƽ�������Σ����以Ϊ�ȵ�����ķ�����SO3��
�ʴ�Ϊ��ƽ�������Σ�SO3��
��4��Cu2+������Χ�����Ų�Ϊ3d9����Cu+������Χ�����Ų�Ϊ3d10��Ϊȫ���ȶ�״̬��Cu2O���ȶ���CuO�ڼ�������������ת��ΪCu2O��
Cuԭ�ӵ���Χ�����Ų�ʽΪ��3d104s1��Cu����Ķѻ���ʽΪ�����������ܶѻ���
�ʴ�Ϊ��Cu2+������Χ�����Ų�Ϊ3d9����Cu+������Χ�����Ų�Ϊ3d10��Ϊȫ���ȶ�״̬��Cu2O���ȶ���3d104s1���ܣ�
��5������P���γ�һ����ĥ����F����ṹ����ʯ���ƣ���ͼ������FΪBP������������廯���D�����廯���ڸ������������ķ�Χ�кϳɣ��ϳ�F�Ļ�ѧ����ʽ��BBr3+PBr3+3H2$\frac{\underline{\;����\;}}{\;}$BP+6HBr��
���ʯ������Cԭ����ĿΪ4+8��$\frac{1}{8}$+6��$\frac{1}{2}$=8������B��Pԭ����Ŀ��Ϊ4����������Ϊ4��$\frac{11+31}{{N}_{A}}$g�������߳�Ϊa pm����þ����ܶ�Ϊ4��$\frac{11+31}{{N}_{A}}$g�£�a��10-10 cm��3=$\frac{4��42}{{N}_{A}����a��1{0}^{-10}��^{3}}$g•cm-3��
�ʴ�Ϊ��BBr3+PBr3+3H2 $\frac{\underline{\;����\;}}{\;}$BP+6HBr��$\frac{4��42}{{N}_{A}����a��1{0}^{-10}��^{3}}$��
���� �����Ƕ����ʽṹ�����ʵĿ��飬�漰��������Ų��������ܡ�������ռ乹�����ӻ���ʽ����������ȣ��Ƕ����ʽṹ����֪ʶ�ۺϿ��飬��Ҫѧ���߱���ʵ�Ļ�����


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
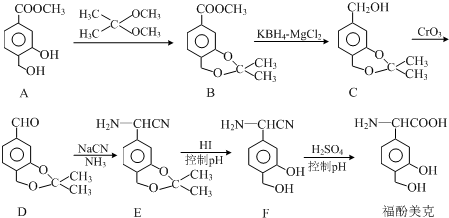
 ��
��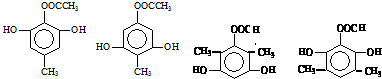 ����һ�֣�
����һ�֣�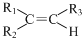 $��_{��Zn/H_{20}}^{��O_{3}}$
$��_{��Zn/H_{20}}^{��O_{3}}$ 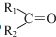 +R3CHO����������֪ʶ����������Ϣ��д����
+R3CHO����������֪ʶ����������Ϣ��д����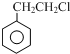 Ϊԭ���Ʊ�
Ϊԭ���Ʊ�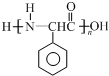 �ĺϳ�·������ͼ�����Լ����ã���
�ĺϳ�·������ͼ�����Լ����ã����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
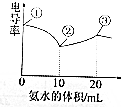 �絼�ʿ����ں����������Һ���������Ĵ�С�������£���0.1000mol/L��ˮ�ζ�10mLŨ�Ⱦ�Ϊ0.100mol/L������ʹ���Ļ��Һ���絼��������ͼ��ʾ������˵��������ǣ�������
�絼�ʿ����ں����������Һ���������Ĵ�С�������£���0.1000mol/L��ˮ�ζ�10mLŨ�Ⱦ�Ϊ0.100mol/L������ʹ���Ļ��Һ���絼��������ͼ��ʾ������˵��������ǣ�������| A�� | �ٵ���Һ��c��H+��Ϊ0.200 mol/L | |
| B�� | �ڵ���Һ��c��Cl-����c��NH4+����c��Ac-�� | |
| C�� | �ٵ���Һ��n���������ӣ�֮�ͣ��۵���Һn���������ӣ�֮�� | |
| D�� | �۵������pH=7�ĵ㣬�˵���Һ��c��NH4+��=c��Ac-��+c��Cl-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
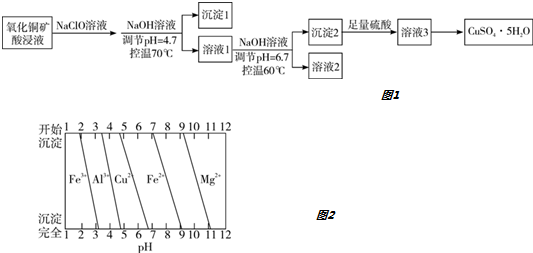
| A�� | ����1����Ҫ�ɷ�ΪAl��OH��3��Fe��OH��3 | |
| B�� | ��Һ2����������������ֻ��Mg2+ | |
| C�� | ����Һ3���ɼ���CuSO4•5H2O���� | |
| D�� | ��������NaClO��Һ�����Ƶ�����ͭ����Ĵ��Ƚ���Ӱ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������R��X | B�� | ���⻯���ȶ���Y��X | ||
| C�� | ��������ϼ�Z��X��Y��R | D�� | ��Z��R�γɵĻ�����Ϊ���ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ����̿/mol | NO/mol | A/mol | B/mol | P/MPa | |
| 200�� | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335�� | 2.005 | 0.0500 | 0.0250 | 0.250 | P |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ��Ŀ�� | ʵ����� | ʵ��ԭ�� | |
| A | �ᴿ������������ص��Ȼ��� | �ڽϸ��¶����Ƶ�Ũ��Һ����ȴ�ᾧ�����ˡ����� | �Ȼ����ܽ�����¶����߱仯����������ܽ�����¶������������� |
| B | ����FeCl3��Һ | ��FeCl3�����ܽ�������������Һ | H+����FeCl3ˮ�� |
| C | ������Һ���Ƿ���NH4+ | ȡ������Һ���Թ��У�����NaOH��Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ������������� | NH3����ˮ�����ʵ���Ҫ������ʽ��NH4+��OH- |
| D | ��֤Fe��OH��3���ܽ��С��Mg��OH��2 | ��FeCl3��Һ����Mg��OH��2����Һ�У��� | 3Mg��OH��2+2Fe3+?2Fe��OH��3+3Mg2+ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
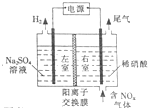 ��ⷨ��������������������ɻ������ᣬ���нϸߵĻ���Ч��;���Ч�森ʵ����ģ���ⷨ����NOx��װ����ͼ��ʾ��ͼ�е缫��Ϊʯī�缫����
��ⷨ��������������������ɻ������ᣬ���нϸߵĻ���Ч��;���Ч�森ʵ����ģ���ⷨ����NOx��װ����ͼ��ʾ��ͼ�е缫��Ϊʯī�缫�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com