
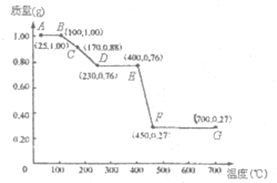
 如图是1.00g MgC2O4•nH2O晶体放在坩埚里从25℃徐徐加热至700℃时,所得同体产物的质量(m)随温度(t)变化的关系曲线.(已知100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水)
如图是1.00g MgC2O4•nH2O晶体放在坩埚里从25℃徐徐加热至700℃时,所得同体产物的质量(m)随温度(t)变化的关系曲线.(已知100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水)分析 (1)230℃时完全失去结晶水,MgC2O4的质量为0.76g,则含结晶水的质量为1.00g-0.76g=0.24g,结合质量之比等于相对分子质量之比计算n;
(2)发生MgC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgC2O4•xH2O+(2-x)H2O,结合质量关系计算;
(3)从E点到F点MgC2O4分解.
解答 解:(1)230℃时完全失去结晶水,MgC2O4的质量为0.76g,则含结晶水的质量为1.00g-0.76g=0.24g,
由质量之比等于相对分子质量之比可知,$\frac{112}{18n}=\frac{0.76g}{0.24g}$,解得n=2,
故答案为:2;
(2)MgC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgC2O4•xH2O+(2-x)H2O
148g (2-x)18g
1.00g (1.00-0.88)g
$\frac{148}{(2-x)×18}$=$\frac{1.00g}{(1.00-0.88)g}$,解得x=1,
B点固体的化学式为MgC2O4•H2O,
故答案为:MgC2O4•H2O;
(3)设发生MgC2O4•H2O$\frac{\underline{\;400-450℃\;}}{\;}$X(s)+Y↑+Z↑,
X(s)应为Mg元素的单质或与其他元素组成化合物,
由Mg的原子守恒可知n(MgC2O4):n(X)=$\frac{0.76g}{112g/mol}$:$\frac{0.27g}{M(X)}$=1:1,解得M(X)=40,
可推测出X即为MgO,则化学方程式为MgC2O4•H2O$\frac{\underline{\;400-450℃\;}}{\;}$MgO+CO↑+CO2↑,
故答案为:MgC2O4•H2O$\frac{\underline{\;400-450℃\;}}{\;}$MgO+CO↑+CO2↑.
点评 本题考查化学反应方程式的计算,侧重于学生的分析与计算能力的考查,为高考常见题型,把握反应中的质量关系为解答的关键,题目难度不大.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.8 | 2.4 | 0.4 | 放出热量:Q |
| A. | 容器①、②中反应的平衡常数相等,平衡时氮气的转化率相等 | |
| B. | 平衡时,两个容器中NH3 的体积分数均为1/8 | |
| C. | 容器②中达平衡时放出的热量Q=4.63 kJ | |
| D. | 若容器①改为恒压体系,充入0.25 L He,则平衡时放出的热量大于23.15 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠的电离方程式为:NaHCO3═Na++HCO3- HCO3-?H++CO32- | |
| B. | 偏铝酸钠的水解方程式为:AlO2-+2H2O═Al(OH)3↓+OH- | |
| C. | 硫化铝溶于水的水解方程式为:Al2S3+6H2O═2Al(OH)3↓+3H2S↑ | |
| D. | 醋酸铵的水解方程式为:CH3COO-+NH4++H2O?CH3COOH+NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某溶液中,可能含有下表所列离子中的某几种:
某溶液中,可能含有下表所列离子中的某几种:| 阳离子 | Al3+、Mg2+、NH4+、Na+ |
| 阴离子 | CO32-、SiO32-、[Al(OH)4]-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被称为“史上最严”的新《环境保护法》正式实施,我们要运用化学原理从源头上减少和消除工业生产对环境的污染 | |
| B. | 天津港爆炸事故救援过程中,消防员若发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
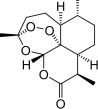
| C. | 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| D. | 某品牌化妆品在广告中反复强调产品中不含任何化学成分,是“十年专注自然护肤”的优质产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和NaOH溶液时溶液的pH变大 | |
| B. | 在镀件上电镀铜时,可以不用金属铜做阳极,只要溶液中存在Cu2+就可以 | |
| C. | 电解稀硫酸制O2、H2时,铜做阳极 | |
| D. | 铝-空气燃料电池通常以NaOH溶液为电解液,电池在工作过程中电解液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 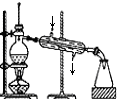 海水蒸馏得到淡水 | |
| B. | 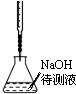 中和滴定 | |
| C. | 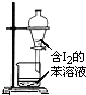 苯萃取碘水中I2,分出水层后的操作 | |
| D. | 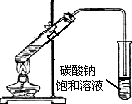 制备乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com