
【题目】设阿伏加德罗常数的值为NA,下列说法中正确的是
A. 17g甲基(—14CH3)所含中子数为9NA
B.常温常压下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
C.0.1molC5H12分子中含有的C-C键数为0.5NA
D.标准状况下,2.24L辛烷在氧气中完全燃烧生成CO2分子数为0.8 NA
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与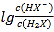 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知X为一种常见酸的浓溶液,能使蔗糖粉末变黑,A与X反应的转化关系如图所示,其中反应条件及部分产物均己略去,则下列有关说法正确的是

A. X使蔗糖变黑的现象主要体现了 X的强氧化性
B. 若A为铁,则A与X在室温下不会反应
C. 若A为碳单质,则将C通入少量的澄淸石灰水中,溶液仍然澄清
D. 工业上在高温、常压和使用催化剂的条件下,可以使B完全转化为D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)溶质的质量分数为b%的KOH溶液,经加热蒸发去ag水后,质量分数变成 2b%,体积为VmL,则此时溶液的物质的量浓度为___________。(答案必须为最简形式)
(2)将6mol/L的盐酸(ρ=1.19g/cm3)50mL稀释成3mol/L的盐酸(ρ=1.10g/cm3),需加水的体积为__________mL。
(3)密度为1.19g/cm3的盐酸,质量分数为25%。该盐酸用等体积的水稀释后,所得溶液中溶质的质量分数_______(填“大于”、“小于”或“等于”)12.5%。
(4)已知20℃时,饱和NaCl溶液的密度为ρg/cm3,物质的量浓度为c mol/L,则饱和NaCl溶液的溶解度为_________g。(答案必须为最简形式)
(5)相同质量的NO2和N2O4的质子数之比为_______,电子数之比为_______________。
(6)请用单线桥表示化学方程式CaH2+2H2O=Ca(OH)2+2H2↑电子转移的方向和数目___________。
(7)若将过量的NaOH溶液加入NH4HCO3溶液中,则反应的化学方程式__________________,若将NaOH溶液加入过量的NH4HCO3溶液中,则反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在密闭容器中进行的可逆反应2SO2(g)+18O2(g)2SO3(g),下列说法正确的是( )
A. 容器内只含有18O2、SO2、SO3三种分子
B. 18O只存在18O2分子中
C. 容器内含有18O2、S18O2、S18O3等分子
D. 反应达到限度时,所有物质的质量都相等
查看答案和解析>>
科目:高中化学 来源: 题型:
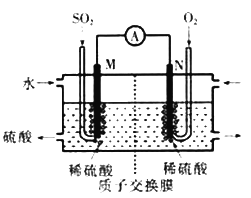
【题目】硫酸工业尾气中的SOj是常见的大气污染物,可通过以下几种方式变废为宝:
(1)电化学处理法:硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料)写出N极发生的电极反应式________________________;溶液中的阳离子向______极(M或N)移动,标准状况下,当有22.4LSO2参加反应时,溶液中有________mol阳离子向该极移动。
(2)钠碱循环法:用Na2SO3溶液作为吸收液来吸收SO2,尾气通入1mol/L的Na2SO3溶液中,①当溶液的PH约为6时,Na2SO3溶液吸收SO2的能力显著下降,此时溶液中c (SO32-)的浓度是0.2mol/L,则此时溶液中离子浓度由大到小的顺序为_______________。
②当溶液的PH降至约为6时,需送至电解槽再生,再生示意图如下:
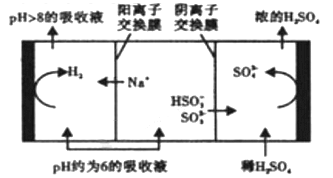
HSO3-在阳极放电的电极反应式是______________________________。
当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古代的很多成语、谚语都蕴含着很多科学知识,下列对成语、谚语的解释正确的是( )
A. “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高
B. “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化
C. “爆竹声中除旧岁,春风送暖入屠苏”爆竹爆炸发生的是分解反应
D. “火树银花”中的焰火实质上是金属元素的焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 元素的种类由最外层电子数决定
B. 化学键是存在于分子、原子和离子间的作用力
C. 原子的种类由原子核内质子数与中子数共同决定
D. 化学反应速率可以决定反应的限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、________________、________。
(2)写出Na2SO3固体氧化变质的化学方程式_____________。
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是__________________________,
在过滤前,需要检验是否沉淀完全,其操作是______________。
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果________(填“偏高”或“偏低”)。
(5)若操作正确,则m1________m2(填“>”、“<”或“=”),原因是_______________。
(6)取25.00 mL上述溶液,用酸性KMnO4溶液滴定的方法测定Na2SO3的纯度。已知酸性条件下,KMnO4通常被还原为Mn2+,则Na2SO3固体的纯度可表示为_____________(注明表达式中所用的有关符号的含义和单位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com