
���� ����c=$\frac{1000�Ѧ�}{M}$����Ũ��������ʵ���Ũ�ȣ�������Һϡ���������ʵ����ʵ����������ϡ�ͺ���Һ�����ʵ���Ũ�ȣ�
������n=$\frac{m}{M}$����þ�����ʵ���������Mg+2HCl=MgCl2+H2���жϷ�Ӧ�����������������������ʵ���������V=nVm�������������������
�����ݷ���ʽ��H2+CuO$\frac{\underline{\;\;��\;\;}}{\;}$Cu+H2O���㱻��ԭ����ͭ��������
�����ݢټ����Ȼ�þ�����ʵ���Ũ�Ⱥ�ʣ����������ʵ���Ũ�ȣ��ݴ˽��
��� �⣺Ũ�����ܶ�Ϊ1.17g/mL����������Ϊ36.5%�����ʵ���Ũ��Ϊ��$\frac{1000��1.17��36.5%}{36.5}$=11.7mol/L����ϡ�ͺ�����Ũ��Ϊc�䣬������Һϡ���������ʵ����ʵ��������11.7mol/L��43mL=c���200mL�����c��=2.52mol/L��
�ʴ�Ϊ��11.7��2.52��
��n��Mg��=$\frac{4.8g}{24g/mol}$=0.2mol��n��HCl��=2.5mol/L��0.2L=0.5mol������Mg+2HCl=MgCl2+H2��֪��0.2molMg��ȫ��Ӧ��Ҫ0.4molHCl��0.5mol������HCl��ʣ�࣬���ݷ���ʽ֪n��Mg��=n��H2��=0.2mol���������������=0.2mol��22.4L/mol=4.48L��
�𣺷ų���H2�ڱ�״���µ����Ϊ4.48L��
�����ݷ���ʽ��H2+CuO$\frac{\underline{\;\;��\;\;}}{\;}$Cu+H2O����֪1mol������ԭ�õ�ͭ������Ϊ64g����0.2mol������ԭ�õ�ͭ������Ϊ0.2��64=12.8g��
�𣺽����ɵ�H2ͨ������������CuO����ԭ����ͭ������12.8g��
�����ݢ�0.2molþ��ȫ��Ӧ�����Ȼ�þ���ʵ���Ϊ0.2mol������0.4mol�Ȼ��⣬��þ�������ʵ���Ũ��Ϊ��$\frac{0.2mol}{0.2L}$=1mol/L��
ʣ���Ȼ������ʵ���Ϊ��0.5mol-0.4mol=0.1mol�������������ʵ���Ũ��Ϊ��$\frac{0.1mol}{0.2L}$=0.5mol/L��
���ԣ���Ӧ������Һ������䣩��Һ��þ�����������������ӵ����ʵ���Ũ��֮�ȣ�1��0.5=2��1��
�𣺷�Ӧ������Һ������䣩��Һ�����������ӵ����ʵ���Ũ��֮�ȣ�2��1��
���� ���⿼�������ʵ���Ũ���йؼ��㣬��ȷ���ʵ���Ũ�ȡ������ٷ���Ũ��֮��Ļ��㣬��Ϥ�����Ļ�ѧ��Ӧ�ǽ���ؼ������ؿ���ѧ������������������ע�⣺�����Ӧ�ﶼ��֪Ҫ���й������㣬Ϊ�״��㣮


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
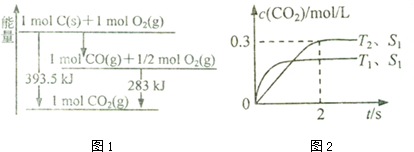
| t/min | 0 | 1 | 2 | 3 | 4 |
| n��H20��/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n��CO��/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ά����Ϣ���ز����ٵ��л��ϳɲ��� | |
| B�� | ������ë�͵���ȼ�պ�ֻ���ɶ�����̼��ˮ | |
| C�� | ���Ȳ�����һ����Ҫ�������洢���ʣ���λ�����Ĵ��Ȳ����ڷ������ڻ�ᾧʱ�����ջ��ͷŽ϶������ | |
| D�� | ú����������Һ���������仯��ת��Ϊ���ȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ɫ������BaSO4��BaSO3 | B�� | FeCl3ȫ������ԭΪFeCl2 | ||
| C�� | ��ɫ������BaSO3 | D�� | ��Һ�����Լ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHCO3������Ca��OH��2�ķ�Ӧ��2HCO3-+Ca2++2OH-�TCaCO3��+CO${\;}_{{3}_{\;}^{\;}}^{2-}$+2H2O | |
| B�� | ����NaͶ����ˮ�У�Na+2H2O�TNa++OH-+H2�� | |
| C�� | CuSO4��Ba��OH��2�ķ�Ӧ��Cu2++SO42-+Ba2++2OH-�TCu��OH��2��+BaSO4�� | |
| D�� | AlCl3��Һ�м���������ˮ��Al3++4OH-�TAlO2-+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com