
【题目】铝及铝的化合物有着极为广泛的用途。
(1)金属铝的生产是以Al2O3为原料,在熔融状态下用石墨做阴极和阳极进行电解:
2Al2O3![]() 4Al+3O2↑,则电解时不断消耗的电极是_____(填“阳极”或“阴极”)
4Al+3O2↑,则电解时不断消耗的电极是_____(填“阳极”或“阴极”)
(2)铝片、石墨、空气和海水构成的原电池可用于航标供电,该原电池正极的电极反应是_____。
(3)泡沫灭火器中NaHCO3溶液和Al2(SO4)3溶液发生反应的离子方程式是______。
(4)在配制AlCl3溶液时,防止溶液出现浑浊现象,溶液中应加入_____。
(5)Mg(OH)2固体能除去镁盐溶液中Al3+,原因是_____。(用离子方程式表示)
【答案】阳极 O2+2H2O+4e-=4OH- Al3++3HCO3-=Al(OH)3↓+3CO2↑ 盐酸 3Mg(OH)2+2Al3+![]() 2Al(OH)3+3Mg2+
2Al(OH)3+3Mg2+
【解析】
(1)金属铝的生产是以Al2O3为原料,在熔融状态下用石墨做阴极和阳极进行电解:2Al2O3![]() 4Al+3O2↑,阳极上氧离子失电子生成氧气,高温下不断与石墨反应,则电解时不断消耗的电极是阳极,故答案为:阳极;
4Al+3O2↑,阳极上氧离子失电子生成氧气,高温下不断与石墨反应,则电解时不断消耗的电极是阳极,故答案为:阳极;
(2)铝片、石墨、空气和海水构成的原电池可用于航标供电, 铝和石墨构成的原电池,铝做负极,在负极发生的反应是Al-3e-=Al3+,在正极反应是O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(3)泡沫灭火器中NaHCO3溶液和Al2(SO4)3溶液发生反应, HCO3-和Al3+均可发生水解,且相互促进,产生气体CO2和沉淀Al(OH)3,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)Al3++3H2O![]() Al(OH)3+3H+由于Al3+的水解,产生Al(OH)3 会出现浑浊现象,要消除浑浊现象,又不污染药品,可加入适量的盐酸,抑制Al3+水解。故答案为:盐酸;
Al(OH)3+3H+由于Al3+的水解,产生Al(OH)3 会出现浑浊现象,要消除浑浊现象,又不污染药品,可加入适量的盐酸,抑制Al3+水解。故答案为:盐酸;
(5)氢氧化铝溶解度更小,Mg(OH)2固体能除去镁盐溶液中Al3+,用离子方程式表示:3Mg(OH)2+2Al3+![]() 2Al(OH)3+3Mg2+。故答案为:3Mg(OH)2+2Al3+
2Al(OH)3+3Mg2+。故答案为:3Mg(OH)2+2Al3+![]() 2Al(OH)3+3Mg2+。
2Al(OH)3+3Mg2+。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】(1)已知氢有3种常见原子:11H、21H、31H(或H、D、T),氯有2种常见核素原子:35Cl、37Cl,氯气与氢气形成的氯化氢分子的相对分子质量有________种。
(2)质量相同的H216O和D216O所含质子数之比为______,中子数之比为________,电解产生的氢气在同温同压下体积之比为________,质量之比为________。
(3)2 g AO32-电子数比质子数多3.01×1022个,则A的相对原子质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如下图所示(EMI+为有机阳离子)。

①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g) △H1= a kJ·mol-1
②3AlCl(g) = 2Al(l)+ AlCl3(g) △H2= b kJ·mol-1
③Al2O3(s)+3C(s) = 2Al(l)+3CO(g) △H3
下列说法正确的是
A.该电池的电解质可用氯化铝水溶液替代
B.Al2O3(s)+3C(s) = 2Al(l)+3CO(g) △H3= (a-b) kJ·mol-1
C.该电池充电时石墨电极与电源正极相连
D.该电池放电时的负极反应方程式为 :Al-3e-+7AlCl4-=4Al2Cl7-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分物质和条件已略去)。A、B、E、G、H、J常温下为气体,A为黄绿色,J为红棕色,B能使湿润的红色石蕊试纸变蓝,E是空气中含量最多的气体,C工业上用于制取漂白粉,K为一种红色金属单质,I是常见的无色液体。
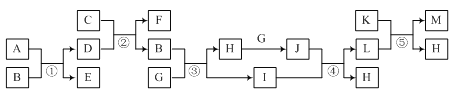
(1)E的化学式为___。
(2)反应②的化学方程式为___。
(3)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:___。
(4)反应⑤的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学利用如图所示装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答下列问题:
A. B.
B.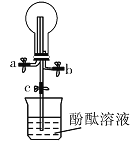
(1)实验室制备氨气的化学方程式为_______。
(2)用装置![]() 收集氨气时,氨气的进气口是______(填“
收集氨气时,氨气的进气口是______(填“![]() ”或“
”或“![]() ”),理由是__________。
”),理由是__________。
(3)打开装置![]() 中的止水夹
中的止水夹![]() ,继续通入氨气,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________、______________。
,继续通入氨气,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺式乌头酸是一种重要的食用增味剂,其结构如下图所示。下列说法正确的是
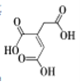
A.该有机物的分子式为:C6H8O6
B.该有机物只含有一种官能团
C.该有机物能使酸性KMnO4溶液、溴的四氯化碳溶液褪色,且原理相同
D.等物质的量的顺式乌头酸分别与足量的NaHCO3和Na反应,产生相同条件下的气体体积之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关描述不正确的是
A.新制饱和氯水和浓硝酸光照下均会有气体产生,其成分中都有氧气
B.灼烧NaOH固体时不能使用瓷坩埚,因为瓷坩埚中的SiO2能与NaOH反应
C.钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同
D.浓硫酸具有较强酸性,能与Cu反应生成H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图的说法不正确的是( )
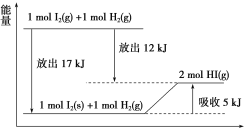
A.1 mol I2(s)与1 mol H2(g)化合生成2 mol HI(g)时,需要吸收5 kJ的能量
B.2 mol HI(g)分解生成1 mol I2(g)与1 mol H2(g)时,需要吸收12 kJ的能量
C.1 mol I2(s)变为1 mol I2(g)时需要吸收17 kJ的能量
D.I2(g)与H2(g)生成2HI(g)的反应是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com