
| A. | Pb是电池的正极 | |
| B. | 负极的电极反应式为:Pb+SO42-+2e -=PbSO4↓ | |
| C. | PbO2得电子,被还原 | |
| D. | 电池充电时,溶液酸性减弱 |
分析 根据放电时的电池反应PbO2+Pb+2H2SO4═2PbSO4+2H2O可知,Pb在反应中失去电子,为电池的负极,PbO2在放电过程中得到电子被还原,所以它是原电池的正极;电池充电时反应逆向进行生成硫酸,所以溶液的酸性增强,据此进行解答.
解答 解:A.原电池中负极失去电子发生氧化反应,根据电池放电时的反应:PbO2+Pb+2H2SO4═2PbSO4+2H2O可知,负极Pb失去电子,即Pb为负极,PbO2为正极,故A错误;
B.根据电池反应可知,Pb在反应中失去电子生成PbSO4,所以负极的电极反应式为:Pb-2e-+SO42-=PbSO4,故B错误;
C.PbO2在放电过程中得到电子被还原,故C正确;
D.电池充电时反应逆向进行生成硫酸,硫酸的浓度增大,所以溶液的酸性增强,故D错误;
故选C.
点评 本题考查了常见的化学电源及工作原理,题目难度中等,注意掌握常见化学电源的类型及工作原理,能够根据原电池总反应判断两极,并能够正确书写电极反应式.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g金属钠变为钠离子时失电子数目为1 NA | |
| B. | 18g水所含有的电子数为NA | |
| C. | 4克氢气所含的分子数为NA | |
| D. | 4gCH4所含有的氢原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有SO42- | B. | 可能有Ag+或SO42- | ||
| C. | 一定无Ag+ | D. | 一定有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 950 mL | B. | 500 mL | C. | 1 000 mL | D. | 任意规格 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 的系统命名4-甲基-2-乙基-1-戊烯
的系统命名4-甲基-2-乙基-1-戊烯 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| B. | 石油的主要成分是烃,煤经过分馏可制得焦炭、煤焦油等产品 | |
| C. | 丙烯分子中所有原子不可能在同一平面上 | |
| D. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
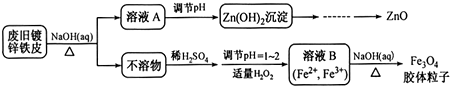
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com