
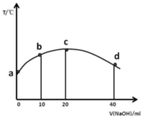
 若往20ml 0.01mol/LCH3COOH溶液中逐滴加入一定浓度的烧碱溶液,测的溶液的温度变化如图所示,下列有关说法正确的是( )
若往20ml 0.01mol/LCH3COOH溶液中逐滴加入一定浓度的烧碱溶液,测的溶液的温度变化如图所示,下列有关说法正确的是( )| A. | c点时,醋酸的电离程度和电离常数都最大,溶液呈中性 | |
| B. | 若b点混合溶液显酸性,则2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 混合溶液中水的电离程度:b>c>d | |
| D. | 由图可知,该反应的中和热先增大后减小 |
分析 A.醋酸是弱电解质,在水溶液里存在电离平衡,电离吸热,温度越高电离平衡常数越大;
B.酸碱反应为放热反应,根据C为酸碱恰好反应,b点碱为酸的一半,结合原子守恒分析解答;
C.酸或碱抑制水电离,根据b、c、d醋酸的电离程度判断;
D.在稀溶液中,酸跟碱发生反应生成1mol液态水时的反应热叫做中和热.
解答 解:A.图中横坐标表示加入的氢氧化钠体积,纵坐标表示温度,醋酸是弱电解质,电离是吸热反应,温度越高电离平衡常数越大,c点时,不是电离平衡常数最大的点,故A错误;
B.酸碱反应为放热反应,往20ml 0.01mol/LCH3COOH溶液中逐滴加入20mlNaOH,C点混合溶液温度最高,为恰好中和,则加入10mlNaOH,此时加入的氢氧化钠为酸的一半,即
根据钠、碳守恒:2c(Na+)=c(CH3COO-)+c(CH3COOH),故B正确;
C.b点溶质为乙酸、乙酸钠,溶液显酸性,抑制水的电离,C点混合溶液温度最高,为恰好中和,溶质为乙酸钠,为强碱弱酸盐,促进水电离,混合溶液中水的电离程度:c
>b,d点加入20ml氢氧化钠,此时溶质为乙酸钠、氢氧化钠,且物质的量浓度为1:1,抑制水的电离,且三个点中抑制程度最大,所以混合溶液中水的电离程度:c>b>d,故C错误;
D.中和热与酸碱的种类有关,与生成1mol液态水时的反应热有关,所以该反应的中和热不变,故D错误;
故选B.
点评 本题考查酸碱混合微粒大小比较等,侧重考查醋酸的电离及图象,明确图中温度与离子浓度的关系是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
 ,形成过程
,形成过程 ;
;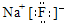 ,形成过程
,形成过程 ;
; ,形成过程
,形成过程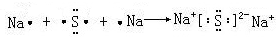 ;
; ;
; ,形成过程
,形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
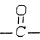 ,则A的可能结构式为
,则A的可能结构式为 、CH3CH2CHO;
、CH3CH2CHO;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合液中由水电离出的c(H+)=1×10-8mol/L | |
| B. | c(A-)+c(HA)=2c(Na+)=0.4mol/L | |
| C. | HA溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$与混合液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$相等 | |
| D. | c(A-)-c(HA)=2c(OH-)-2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (K+)>c (CH3COO-)>c(H+)>c (OH-) | B. | c(K+)=c (CH3COO-)>c (OH-)=c (H+) | ||
| C. | c(K+)+c (H+)═c(CH3COOH)+c (OH-) | D. | c (CH3COOH)+c (CH3COO-)=0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
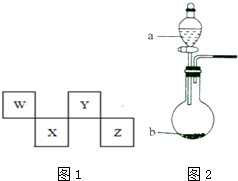 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物. ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨就是pH<7的雨水,主要是由大气中的SO2、NO2等造成的 | |
| B. | 饱和氯水既有酸性又有漂白性,加入NaHCO₃后漂白性减弱 | |
| C. | 烧融烧碱应选用的器皿是铁坩埚而不是石英坩埚、普通玻璃坩埚或陶瓷坩埚 | |
| D. | 用纯碱制玻璃、用铁矿石炼铁、用氨制碳酸铵都会产生温室气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com