
|
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点.下图是 KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH的混合溶液的滴定曲线的是
| |
| [ ] | |
A. |
|
B. |
|
C. |
|
D. |
|
|
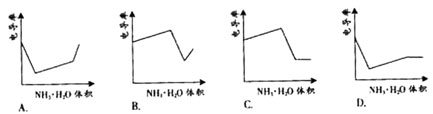
讲析: HCl是强电解质,在水溶液中完全电离,CH3COOH是弱电解质,在水溶液中部分电离.用NH3·H2O溶液滴定HCl和CH3COOH的混合溶液时,(1)NH3·H2O先和HCl反应,生成NH4Cl(强电解质),但由于溶液体积增大,因此电导率下降;(2)HCl被中和完全后,NH3·H2O开始与CH3COOH反应生成CH3COONH4(强电解质),溶液体积增大,但二因素作用后的结果是体系的电导率增大;(3)CH3COOH被中和完全后,继续滴加NH3·H2O(弱电解质),溶液的电导率下降. 点评:本题主要考查同学们对强、弱电解质的理解及掌握情况,同时还考查了同学们的视图能力以及融汇知识的能力. |


科目:高中化学 来源: 题型:
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率
变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶
液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表
示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com