
A
B C D E F
G H I
a
b
c
d
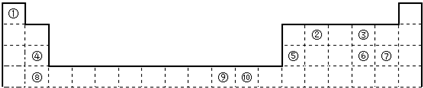
(1)在上面元素周期表中全部是金属元素的区域为 。
(A)a (B)b (C)c (D)d
(2)G元素与 E元素形成的化合物中阴阳离子个数比为1:1的物质的化学式是 ,
表格中九种元素的最高价氧化物对应的水化物中,碱性最强的化合物的电子式是 ,酸性最强的是 (用化合物的化学式表示,下同),属于两性氢氧化物的是 。
(3)C、D、E、F四种元素中,气态氢化物稳定性最差的物质的空间结构为 。
(4)G、H两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。(填编号)
(a)看那种原子失去的电子越多,金属性越强。
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
(16分,每空2分)
(1) B 。
(2)Na2O2,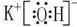 , HClO4 , Al(OH)3 。
, HClO4 , Al(OH)3 。
(3) 正四面体。
(4)钠, bc。
【解析】
试题分析::(1)在周期表中,只有过渡元素全部是金属元素,故答案为:b;
(2)根据元素在周期表中的分布,可以确定G元素是Na,E元素是O,二者形成的化合物是氧化钠和过氧化钠,二者均是金属活泼金属和活泼非金属之间形成的离子化合物,周期表中从左到右元素最高价氧化物对应水化物的碱的碱性逐渐增减弱,从上到下元素最高价氧化物对应水化物的碱的碱性逐渐增强,所以酸性最强的是HClO4;碱性最强的是KOH;具有两性的是Al(OH)3;
(3)C、D、E、F四种元素中,气态氢化物稳定性最差的物质的空间结构为正四面体。
(4)室温下,H为Al元素,G为Na元素,金属性较强的是钠,金属镁和热水反应而金属铝和热水不反应,可以确定金属性的强弱,或是根据金属和酸反应置换出氢气的难易来判断,或是根据最高价氧化物对应水化物的碱性来判断,故答案为:钠;bc。
考点:元素周期律和元素周期表的综合应用
点评:本题考查学生元素周期表的内容和元素周期律的综合知识,要求学生具有分析和解决问题的能力,难度不大。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 电子能I(Ev) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 仪器编号 | a | b | c | d | e |
| 名称 | 试管 | 溶量瓶 | 集气瓶 | 碱式滴定管 | 普通漏斗 |
| 改正的名称 | 无 无 |
容量瓶 容量瓶 |
无 无 |
酸式滴定管 酸式滴定管 |
无 无 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | |
| A | ↓ | - | ↓ | - | |
| B | ↓ | ↓ | - | ||
| C | - | ↓ | ↑ | - | |
| D | ↓ | ↓ | ↑ | ↓ | |
| E | - | - | - | ↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:
下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| 最高化合价 | +6 | +4 | +5 | +5 | +4 | +7 | ||
| 最低化合价 | -2 | -4 | -2 | -3 | -1 | -3 | -4 | -1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com