
| A. | 1mol碳正离子CH5+所含的电子数为11NA | |
| B. | 标准状况下,22.4L辛烷完全燃烧后生成二氧化碳分子数为8NA | |
| C. | 0.5mol乙烷分子中含共价键3.5NA | |
| D. | 乙烷可以发生氧化反应和取代反应.30g乙烷完全燃烧消耗3.5mol氧气,与氯气反应生成C2H4Cl2时,一定为纯净物 |
分析 A.CH5+中含10个电子;
B.标况下辛烷为液态;
C.根据乙烷分子的物质的量及结构计算出含有的共价键数目;
D.烷烃取代反应伴有多个副反应.
解答 解:A.CH5+中含10个电子,故1molCH5+中含10mol电子即10NA个,故A错误;
B.标况下辛烷为液态,故22.4L辛烷的物质的量不是1mol,故B错误;
C.1mol乙烷分子中含有1mol碳碳共价键和6mol碳氢共价键,总共含有7mol共价键,则0.5mol乙烷分子中含共价键3.5NA,故C正确;
D.烷烃取代反应伴有多个副反应,所以得到的取代产物一定为混合物,故D错误;
故选:C.
点评 本题考查有关物质的量及阿伏伽德罗常数的计算,注意掌握阿伏伽德罗常数与物质的量、摩尔质量等物理量之间的转化是解题关键,注意有机物结构特点,题目难度不大.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液 | B. | 新制Cu(OH)2悬浊液 | C. | 石蕊试液 | D. | 溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
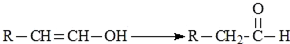
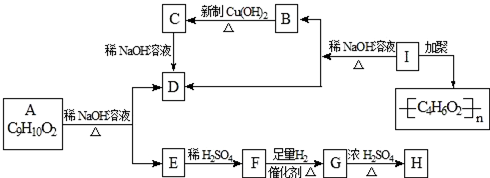
 ,H:CH3COOCH=CH2.
,H:CH3COOCH=CH2.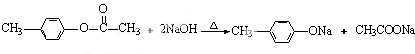 +H2O.
+H2O. ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
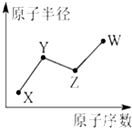 U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随
U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随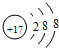 ;
;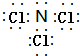 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 石墨燃烧热为-393.5kJ/mol | |
| B. | CO2和金刚石(或石墨)反应生成CO为吸热反应 | |
| C. | 等量金刚石和石墨完全燃烧,石墨放出的热量更多 | |
| D. | 12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向2%的稀氨水中滴入2%的硝酸银溶液至沉淀恰好溶解,配得银氨溶液 | |
| B. | 实验前试管先用热的烧碱溶液洗涤,再用蒸馏水洗涤 | |
| C. | 醛类一定能发生银镜反应,能发生银镜反应的一定是醛类 | |
| D. | 可用浓盐酸洗去银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
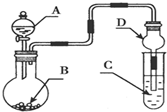
| A. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 | |
| B. | 若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色 | |
| C. | 若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊 | |
| D. | 若A为浓H2SO4,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com