

 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr. 分析 (1)苯与液溴反应生成HBr,HBr遇水蒸气形成白雾;苯的卤代反应是放热反应,液溴易挥发,所以尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气;
(2)溴苯中含有溴,单质溴能与NaOH溶液反应生成NaBr和NaBrO溶于水中,而溴苯不与NaOH溶液反应,也不溶于水,分液后,然后加干燥剂;
(3)根据分离出的粗溴苯中含有未反应的苯,分离互溶的液体,利用沸点不同,可采用蒸馏的方法进行分离;
(4)根据制取溴苯所加的液体的体积以及溶液的体积一般不超容器的$\frac{2}{3}$,不少于$\frac{1}{3}$;
(5)在铁作催化剂条件下,苯和液溴发生取代反应溴苯.
解答 解:(1)苯与液溴反应生成HBr,HBr遇水蒸气形成白雾;苯的卤代反应是放热反应,液溴易挥发,所以尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气,
故答案为:HBr;吸收HBr和Br2;
(2)溴苯提纯的方法是:先水洗,把可溶物溶解在水中,然后过滤除去未反应的铁屑,再加NaOH溶液,把未反应的Br2变成NaBr和NaBrO洗到水中,然后加干燥剂,无水氯化钙能干燥溴苯,
故答案为:除去HBr和未反应的Br2;干燥;
(3)反应后得到的溴苯中溶有少量未反应的苯,苯和溴苯互溶,但苯的沸点低,所以采用蒸馏的方法进行分离,溴苯留在母液中,
故答案为:苯;C;
(4)操作过程中,先在a中加入15mL无水苯,在b中小心加入4.0mL液态溴,最后向a中加入10mL水,共约30mL,所以a的容积最适合的是50mL,
故答案为:B;
(5)在铁作催化剂条件下,苯和液溴发生取代反应溴苯,反应方程式为 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,
+HBr,
故答案为: +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.
点评 本题考查物质制备实验,为高频考点,明确实验原理是解本题关键,知道实验操作步骤及基本操作方法,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学键断裂时吸收能量,形成时放出能量 | |
| B. | 燃烧热是1mol可燃物完全燃烧释放的能量 | |
| C. | 中和热是稀酸与稀碱反应生成1molH2O释放的能量 | |
| D. | 燃料电池能将全部化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如图:
实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如图:| 相对分子数量 | 密度 | 沸点 | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环乙烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
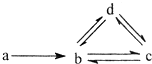 下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )| a | b | c | d | |
| ① | Si | SiO2 | H2SiO3 | Na2SiO3 |
| ② | N2 | NO | NO2 | HNO3 |
| ③ | Cu | CuO | Cu(OH)2 | CuSO4 |
| ④ | Na | NaCl | Na2CO3 | NaHCO3 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com