铁是人类利用最为广泛的金属之一,工业炼铁一般用一氧化碳作还原剂.
(1)已知Fe
2O
3在高炉中有下列反应:Fe
2O
3+CO
2FeO+CO
2.反应形成的Fe
2O
3和FeO固体混合物中,元素铁和氧的质量比m(Fe):m(O)不可能是
.
a.7:3 b.21:8 c.14:5 d.7:2
(2)若m(Fe):m(O)=3:1,则Fe
2O
3与FeO的物质的量之比为
,Fe
2O
3被CO还原的物质的量分数为
.
(3)3.04g Fe
2O
3和FeO的混合固体粉末在加热条件下用足量CO使金属氧化物完全还原,生成的CO
2气体通入过量澄清石灰水将生成的气体充分吸收,产生沉淀5g,计算固体粉末中Fe
2O
3的质量.(保留1位小数)
(4)常温下,称取不同铁锈样品溶入足量盐酸,向溶液中加入足量NaOH溶液生成沉淀,然后过滤、洗涤、灼烧,得到Fe
2O
3固体,实验过程中产品无损失.
实验数据记录如下:
| 实验序号 |
铁锈质量/g |
氧化铁质量/g |
| ① |
0.856 |
0.640 |
| ② |
1.424 |
1.280 |
| ③ |
0.979 |
0.880 |
| ④ |
1.070 |
0.800 |
上述实验①②③④所用铁锈均不含杂质,且实验数据可靠.通过计算,分析和比较上表4组数据,给出结论.



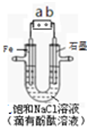 如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( ) 元素及其化合物在生产、生活中具有广泛的用途.
元素及其化合物在生产、生活中具有广泛的用途.

 的高聚物,其单体是甲醛和苯酚
的高聚物,其单体是甲醛和苯酚