
分析 (1)根据配制一定物质的量浓度溶液的操作步骤选取实验仪器;
(2)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸溶液的体积;根据浓硫酸的体积选取量筒,注意所选量筒的容积应稍大于或等于量取溶液的体积;
(3)依据配制一定物质的量浓度溶液的操作步骤判断;分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
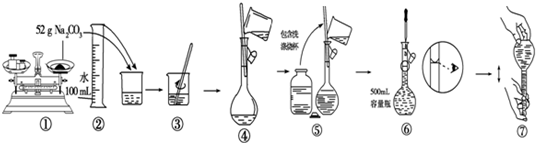
解答 解:(1)配制一定物质的量浓度硫酸溶液的一般步骤有:量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸溶液在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、量筒、胶头滴管、小烧杯、500ml容量瓶,所以用不到的仪器有烧瓶、托盘天平、药匙,还缺少的仪器为:500ml容量瓶;
故答案为:②⑥⑦; 500ml容量瓶;
(2)质量分数98%密度为1.84g•cm-3浓H2SO4的物质的量浓度=$\frac{1000×1.84×98%}{98}$=18.4mol/L;设需要浓硫酸溶液的体积为V,0.2mol•L-1×500ml=V×18.4mol/L,解得:V=5.4ml,应选择10ml量筒;
故答案为:5.4ml;①;
(3)A.用量筒量取浓硫酸时,仰视量筒的刻度,导致量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液浓度偏高,故A选;
B.容量瓶底部有少量蒸馏水,未经干燥就用来配制溶液,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故B不选;
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容,冷却后液面下降,溶液体积偏小,溶液浓度偏高,故C不选;
D.往容量瓶转移时,有少量液体溅出,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故D不选;
E.烧杯未进行洗涤,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故E不选;
F.在容量瓶中定容时俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高,故F选;
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故G不选;
故选:ACF.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉配制原理和过程是解题关键,转移容量瓶的选择和使用注意事项,注意误差的分析,注意容量瓶方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在任何条件下,化学反应的焓变都等于化学反应的反应热 | |
| B. | △H>0时反应放热,△H<0时反应吸热 | |
| C. | △H越大,说明反应放出的热量越多 | |
| D. | 一个化学反应中,当反应物能量大于生成物能量时,反应放热,△H为“-” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
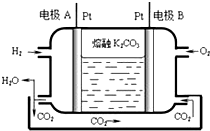 一种新型氢氧燃料电池工作原理如图所示.
一种新型氢氧燃料电池工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏常用于分离提纯液态有机混合物 | |
| B. | 核磁共振氢谱通常用于分析有机物中氢的个数 | |
| C. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 | |
| D. | 燃烧法是研究确定有机物元素组成的有效方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同族元素中Z的氢化物稳定性最高 | |
| B. | 原子半径:X>Y,离子半径:X+>Z2- | |
| C. | 同周期元素中X的金属性最强 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com