
下列离子方程式,正确的是
A.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2 + 2H+ = Ca2+ + 2H2O + 2CO2↑
B.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO + Ca2++ OH-= CaCO3↓+ H2O
+ Ca2++ OH-= CaCO3↓+ H2O
C.向氢氧化钡溶液中加硫酸溶液:Ba2++SO42- + H+ + OH- === BaSO4↓+ H2O
D.向NaHSO4溶液中滴加少量的Ba(OH)2溶液: Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O
科目:高中化学 来源: 题型:
把河沙(主要成分是SiO2)跟镁粉按一定质量比(质量比大约为15∶24)混合均匀,装入试管中加热大约1 min后停止加热,发生剧烈反应,生成一种白色固体化合物和一种硅化物。待生成混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
(1)写出河沙与镁粉在加热条件下的化学方程式________________,该反应是________(填“放热”或“吸热”)反应。
(2)生成的混合物放入稀硫酸中,产生的气体是________(填化学式)。
(3)写出产生“爆炸声”的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析:
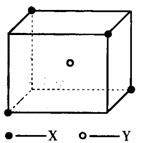 (1)晶体中每个Y同时吸引着__________个X,每个x同时
(1)晶体中每个Y同时吸引着__________个X,每个x同时
吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有
__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹∠XYX的
度数为__________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ·cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是
A.将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA
B.1 L 0.1 mol/L NaHSO4溶液中含有0.1 NA个HSO4-
C.常温常压下,23 g NO2和N2O4的混合气体一定含有NA个氧原子
D.1 mol铁与足量稀盐酸反应转移的电子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,将22.4 L HCl完全溶于1 L水中(水的密度近似为1 g/mL),溶液的密度为ρ g/cm3,溶液的体积为V mL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
①w= ×100% ②c=1 mol·L-1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w ④所得溶液中含有NA个HCl分子
×100% ②c=1 mol·L-1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w ④所得溶液中含有NA个HCl分子
A.全部 B.①③④ C.①③ D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
化学知识在生产、生活中有着广泛的应用。下列说法中不正确的是:
A.用植物秸秆、动物粪便等生产的沼气是一种清洁的能源
B.手机上用的锂离子电池属于二次电池
C.海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化
D.研制开发燃料电池汽车,可有效降低机动车尾气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是一种重要的金属资源,工业上制取镁单质主要是电解法。
(1)电解法制取镁单质的反应方程式是:______________________________。
(2)电解原料无水氯化镁可由海水制备。主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶。
其步骤先后顺序是__________________________________;(每步骤可重复使用)
(3)上述步骤①中“一定条件下”具体是指:_______________________________,其目的是___________________________________________。
(4)已知某温度下Mg(OH)2的Ksp=6.4×l0−12,当溶液中c(Mg2+)≤1.0×10−5mol·L−1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥_________________ mol·L−1。
(5)饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,看到的现象是___________。反应原理可能有两方面,请分别用离子方程式表示:
①________________________________________________;
②________________________________________________。
要验证①②谁是Mg(OH)2溶解的主要原因,可选取________代替NH4Cl溶液作对照实验。
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一。一种“镁—次氯酸盐”电池的总反应为:
Mg + ClO- + H2O == Mg(OH)2 + Cl- 。其工作时正极的电极反应式:_________________;用此镁电池给铅蓄电池充电,下列说法中正确的是______________________________。
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24 g Mg,阴、阳极的质量变化之比为3︰2
D.充电后,镁电池和铅蓄电池的pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
某一离子反应体系有反应物和产物共以下六种:
MnO4-、H+、O2、H2O、H2O2、Mn2+,
已知该反应中的H2O2只发生如下过程: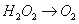
(1)该反应中的还原剂是 ,还原产物是________。
(2)KMnO4溶液随着酸性的增强氧化性不断增强,应选择_______(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
(3)假如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com