
分析 (1)依据电池反应分析,充电为电解池,放电为原电池;放电过程中原电池的负极上失电子发生氧化反应,正极上发生还原反应;
(2)放电时的电极反应是:负极:Fe-2e-+2OH-=Fe(OH)2;
(3)放电时正极发生还原反应,正极反应式为:NiO2+2e-+2H2O=Ni(OH)2+2OH-,充电时该电极发生氧化反应,是该电极反应的逆反应;
(4)①由电子守恒可知,电解M(NO3)x溶液时,某一极增加了agM,2M~2xe-~xH2O;
②由离子放电顺序可知,电解含有0.01molCuSO4和0.01molNaCl的混合溶液100ml,阳极上氯离子和氢氧根离子放电生成氯气和氧气,2Cl--2e-=Cl2↑,阴极上铜离子得电子,以此计算.
解答 解:(1)根据原电池在放电时,负极发生氧化反应,正极发生还原反应,再根据元素化合价变化,可判断该电池负极发生反应的物质为Fe被氧化发生氧化反应,正极为NiO2,被还原发生还原反应,此电池为碱性电池,在书写电极反应和总电池反应方程式时不能出现H+,故放电时的电极反应是:负极:Fe-2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-,
故答案为:A;
(2)放电时的电极反应是:负极:Fe-2e-+2OH-=Fe(OH)2,正极反应式:NiO2+2e-+2H2O=Ni(OH)2+2OH-,所以pH增大,故答案为:增大;
(3)放电时正极发生还原反应,正极反应式为:NiO2+2e-+2H2O=Ni(OH)2+2OH-,充电时该电极发生氧化反应,是该电极反应的逆反应,电极反应式为:Ni(OH)2+2OH--2e-=NiO2+2H2O,故答案为:Ni(OH)2+2OH--2e-=NiO2+2H2O;
(4)①由电子守恒可知,电解M(NO3)x溶液时,某一极增加了agM,2M~2xe-~xH2O,则设M的相对原子质量为y,
2M~2xe-~xH2O
2y 2 x
a 0.02mol
解得y=50ax,故答案为:50ax;
②电解含有0.01mol CuSO4和0.01molNaCl的混合溶液100mL,电路中转移了0.02mol e-,
阳极:2Cl--2e-=Cl2↑,
0.01mol 0.01mol 0.005mol
4OH--4e-=2H2O+O2↑,
0.01mol 0.01mol 0.0025mol
阴极:Cu2++2e-=Cu
0.01mol 0.02mol
所以阳极上生成的气体在标准状况下的体积=(0.005mol+0.0025mol)×22.4L/mol=0.168L=168mL;
阳极氢氧根离子减少0.01mol,则溶液中氢离子增加0.01mol,将电解后的溶液加水稀释至1L,溶液中氢离子浓度=$\frac{0.01mol}{1L}$=0.01mol/L,溶液pH=2;
故答案为:168mL;2.
点评 本题以原电池为载体考查了化学电源新型电池,原电池的工作原理为依据,判断该电池的正负极及电极反应式.要学会从教材中找出知识点原型进行知识迁移、解决问题的方法,题目难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:解答题
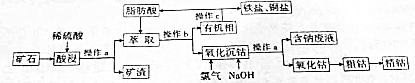
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
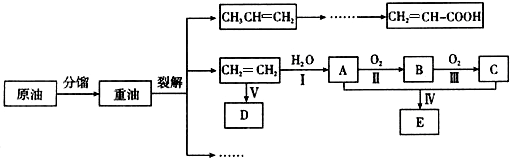
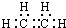 .
.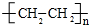 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | 全部 | C. | ②④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
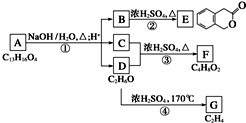 图中A、B、C、D、E、F、G均为有机化合物.根据下图回答问题.
图中A、B、C、D、E、F、G均为有机化合物.根据下图回答问题. .反应①的反应类型是水解反应(取代反应).
.反应①的反应类型是水解反应(取代反应).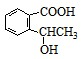 、
、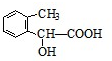 、
、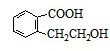 .
.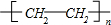 或CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH.
或CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应为:O2+2H2O+4e-═4OH- | |
| B. | 放电时CO32-向负极移动 | |
| C. | 电池供应1mol水蒸气,转移电子4mol | |
| D. | 放电时正极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
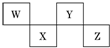
| A. | W、Y可形成两种不同的化合物 | |
| B. | Z的阴离子电子层结构与氩原子的相同 | |
| C. | W的简单氢化物的沸点比Y的氢化物的沸点高 | |
| D. | Y元素的非金属性比W元素的非金属性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com