
| A. | 0.02mol/(L•s) | B. | 1.8mol(L•s) | C. | 1.2mol/(L•s) | D. | 0.18mol/(L•s) |
分析 根据v=$\frac{△c}{△t}$计算v(H2SO4),铝与硫酸发生反应2Al+3H2SO4═Al2(SO4)3+3H2↑,利用速率之比等于化学计量数之比,所以v[Al2(SO4)3]=$\frac{1}{3}$v(H2SO4),据此计算.
解答 解:10s末硫酸的浓度减少了0.6mol/L,所以v(H2SO4)=$\frac{0.6mol/L}{10s}$=0.06mol/(L•s)
铝与硫酸发生反应2Al+3H2SO4═Al2(SO4)3+3H2↑,利用速率之比等于化学计量数之比,
所以v[Al2(SO4)3]=$\frac{1}{3}$v(H2SO4)=$\frac{1}{3}$×0.06mol/(L•s)=0.02mol/(L•s).
故选A.
点评 本题考查反应速率的计算,难度不大,常用速率计算方法有定义法与化学计量数法,掌握基础是解题关键.


科目:高中化学 来源: 题型:选择题
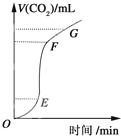
| A. | OE段表示反应速率最快 | |
| B. | EF段表示反应速率最快,收集的CO2最多 | |
| C. | FG段表示收集的CO2最多 | |
| D. | OG段表示随着时间的推移,反应速率逐渐增快 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46 g钠与氧气完全反应生成Na2O和Na2O2,转移电子数可能为3NA | |
| B. | 向含2 mol FeI2的溶液中通入足量Cl2,消耗氯气分子数为NA | |
| C. | 2 mol Cu与足量硫粉完全反应,转移电子数为2NA | |
| D. | 1 mol Al2Fe(SO4)4固体中含Fe3+的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 12H | 2Hc | Cl2 | Cu2+ | |
| A | 质量数 | 中子数 | 质子数 | 电荷数 |
| B | 质量数 | 质子数 | 原子数 | 电荷数 |
| C | 质子数 | 中子数 | 原子数 | 电子数 |
| D | 质量数 | 质子数 | 分子数 | 电荷数 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a和b用导线连接时,该装置为原电池,铁片为负极,发生氧化反应 | |
| B. | a和b用导线连接时,Pt片上发生的反应为:Cu2++2e-═Cu | |
| C. | a和b分别连接直流电源正、负极时,该装置为电解池,Pt片为阳极,电极反应式为:4OH--4e-═O2↑+2H2O | |
| D. | a和b分别连接直流电源正、负极时,Cu2+向Pt电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
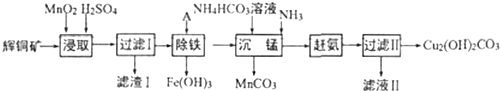
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com