
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为____。
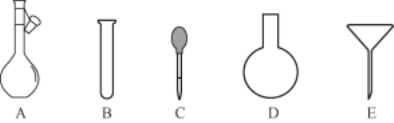
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是___;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要如图中的____(填字母代号)。
(3)滴定终点的判定现象是____。
(4)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/LNH4Fe(SO4)2 标准溶液V mL,则TiO2质量分数表达式为____。
(5)下列操作对TiO2质量分数测定结果偏高的是(______)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出
②若在滴定终点读取滴定管刻度时,俯视标准液液面
③若在滴定时滴定前尖嘴部分有气泡,滴定后无气泡
【答案】TiCl4+(2+x)H2O=TiO2·xH2O↓+4HCl 抑制NH4 Fe(SO4)2水解 AC 溶液变成红色,并且在半分钟内不褪色 ![]() 或
或![]() % ①③
% ①③
【解析】
配制盐溶液时,若盐易水解,则在盐溶解于水的过程中,会生成水解产物,从而使溶液变浑浊。所以,应先将盐的晶体溶解在对应的酸中,然后加水稀释至所需的浓度。
(1)TiCl4水解生成TiO2·xH2O的化学方程式为TiCl4+(2+x)H2O=TiO2·xH2O↓+4HCl;
(2)配制NH4Fe(SO4)2标准溶液时,因为盐中的Fe2+、NH4+都易发生水解,生成碱和酸,所以应设法阻止水解反应的发生,即加入一定量H2SO4;配制一定物质的量浓度的溶液,除去使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要使用胶头滴管和容量瓶;答案为:AC;
(3)滴定终点时,NH4Fe(SO4)2溶液稍过量,它能使KSCN溶液变红色,所以判定滴定终点的现象是溶液变成红色,并且在半分钟内不褪色;
(4)滴定分析时,有下列转化:TiO2——Ti3+——Fe3+
TiO2质量分数为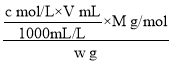 =
=![]() ;
;
(5)①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,则c[NH4Fe(SO4)2]偏小,V偏大,所以对TiO2质量分数测定结果偏高,①正确;
②若在滴定终点读取滴定管刻度时,俯视标准液液面,V偏小,所以对TiO2质量分数测定结果偏低,②错误;
③若在滴定时滴定前尖嘴部分有气泡,滴定后无气泡,则V偏大,所以对TiO2质量分数测定结果偏高,③正确;
由以上分析知,①③符合题意;故选①③。


科目:高中化学 来源: 题型:
【题目】常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | c(HA)/mol·L-1 | c(NaOH)/ mol·L-1 | 混合溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.2 | 0.2 | pH=9 |
丙 | c1 | 0.2 | pH=7 |
丁 | 0.2 | 0.1 | pH<7 |
下列判断正确的是
A. a>9B. 在乙组混合液中由水电离出的c(OH-)=10-5 mol·L-1
C. c1=0.2D. 丁组混合液中:c(Na+)>c(A-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应2A(g)![]() B(g)+3C(g),反应处于平衡状态的是( )
B(g)+3C(g),反应处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | v(A)=2mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
B | v(A)=2mol·L-1·min-1 | v(C)=2mol·L-1·min-1 |
C | v(A)=1mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
D | v(A)=1mol·L-1·min-1 | v(C)=1.5mol·L-1·min-1 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,浓度都是lmol/L的两种单质气体X2和Y2,在密闭容器中反应生成气体Z。达到平衡时,X2、Y2、Z的浓度分别为0.4mol/L、0.8mol/L、0.4mol/L则该反应的化学方程式是____________________________。
(2)298K时,合成氨反应的热化学方程式为N2(g)+3H2(g)2NH3(g);△H=-92.4kJ/mol,在该温度下,取lmolN2和3molH2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总是小于92.4kJ,其原因是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵是一种重要的化工原料,通常用合成氨及合成硝酸的产物进行生产
(1)硝酸铵水溶液pH__________7(填“>”、“=”或“<”),其水溶液中各种离子浓度大小关系为___________
(2)已知合成氨的热化学方程式为:N2(g)+ 3H2(g)![]() 2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
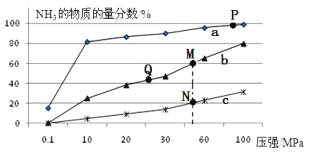
①曲线c对应的温度为___________ ℃
②下列说法中正确的是___________
A.增大氢气浓度,可促进平衡正向移动并能提高氮气的转化率
B.Q点对应的反应条件下,若加入适当的催化剂,可提高NH3在混合物中的物质的量分数
C.M、N两点的平衡常数大小关系为:M>N
D.M、N、Q三点反应速率的大小关系为:N>M>Q
E.为了尽可能多的得到NH3,应当选择P点对应的温度和压强作为生产条件
(3)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(4)柴油汽车尾气净化器通常用尿素作为氮氧化物尾气的吸收剂,生成物均为无毒无污染的常见物质,请写出尿素与NO反应的化学方程式__________,当有1mol尿素完全反应时,转移电子的数目为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于可逆反应的是( )
A.工业上利用氮气和氢气合成氨气
B.![]() 和
和![]()
C.密闭容器中的二氧化氮和四氧化二氮在一定压强下可以相互转化
D.密闭容器中的二氧化硫和氧气在一定条件下可以生成三氧化硫,同时三氧化硫又可以分解为二氧化硫和氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同系物的说法中正确的是![]()
![]() C3H8和C5H12的关系一定是同系物
C3H8和C5H12的关系一定是同系物
![]() 分子组成相差一个或几个
分子组成相差一个或几个![]() 原子团的有机物是同系物
原子团的有机物是同系物
![]() 若烃中碳、氢元素的质量分数相同,它们不一定是同系物
若烃中碳、氢元素的质量分数相同,它们不一定是同系物
![]() 同系物的化学性质相似,同分异构体的化学性质一定不相似
同系物的化学性质相似,同分异构体的化学性质一定不相似
![]() 乙烯和聚乙烯互为同系物
乙烯和聚乙烯互为同系物
⑥![]() 与
与![]() 互为同系物
互为同系物
A. ②⑥ B. ③⑤ C. ①③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
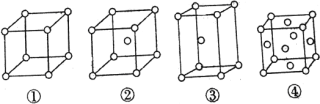
A. ①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为①1个②2个③4个④4个
C. 晶胞中原子的配位数分别为①6 ②8 ③12 ④12
D. 空间利用率的大小关系为①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.![]()
![]() 的
的![]() 溶液中:
溶液中:![]()
B.![]() 的
的![]() 溶液中:
溶液中:![]()
C.![]() 的
的![]() 溶液与
溶液与![]() 的NaOH溶液等体积混合溶液显碱性,其混合溶液中:
的NaOH溶液等体积混合溶液显碱性,其混合溶液中:![]()
D.pH相等的![]() 、
、![]() 、
、![]() 三种溶液中,
三种溶液中,![]() 大小:
大小:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com