
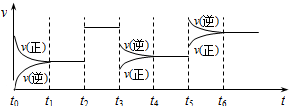
| A、t2时加入了催化剂(其它条件不变) |
| B、t3时降低了温度(其它条件不变) |
| C、t5时增大了压强(缩小容器体积,其它条件不变) |
| D、平衡状态时,t6时刻Z的百分含量最低 |


科目:高中化学 来源: 题型:
| A、非金属单质燃烧时火焰均为无色 |
| B、所有金属及其化合物灼烧时火焰均有颜色 |
| C、焰色反应均应透过蓝色钴玻璃观察 |
| D、NaCl与Na2CO3灼烧时火焰颜色相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、②③④ |
| C、①②③⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、活化分子的总数越多,反应速率越快 |
| B、升高温度,活化分子百分数不变,活化分子数增多,化学反应速率增大 |
| C、使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率增大 |
| D、加入反应物,使活化分子百分数增大,化学反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCN分子的结构式:H-C≡N |
B、二氧化碳的电子式: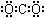 |
C、Cl-的结构示意图为: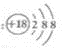 |
| D、乙烯的结构简式为CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com