
在理论上可用来设计原电池的反应是
| A.Fe +2HCl =" Fe" Cl2+ H2 |
| B.NaOH +HCl="NaCl+" H2O |
| C.Cu SO4 +2NaOH= Cu(OH)2+Na2 SO4 |
| D.Ca CO3+2HCl=" Ca" Cl2+ H2O+ CO2 |
科目:高中化学 来源: 题型:单选题
如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16 g,乙池中某电极上析出0.64 g某金属,下列说法正确的是
| A.甲池b极上析出金属银,乙池c极上析出某金属 |
| B.甲池a极上析出金属银,乙池d极上析出某金属 |
| C.某盐溶液可能是CuSO4溶液 |
| D.某盐溶液可能是Mg(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某同体酸燃料电池以Ca(HSO )
) 固体为电解质传递H
固体为电解质传递H ,其基本结构如图所示,电池总反应可表示为:2H
,其基本结构如图所示,电池总反应可表示为:2H +O
+O =2H
=2H O,下列有关说法错误的是
O,下列有关说法错误的是
| A.电子通过外电路从a极流向b极 |
B.b极上的电极反应式为:O +4H +4H +4e +4e =2H =2H O O |
| C.每转移0.4 mol电子,生成3.6g水 |
D.H 由b极通过固体酸电解质传递到a极 由b极通过固体酸电解质传递到a极 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是( ) 
| A.电池内部含有电解质 | B.锌是负极,碳棒是正极 |
| C.电池用完后可埋入土壤 | D.锌锰干电池属一次电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将锌片和铜片用导线连接后放入硫酸铜溶液中,发生原电池反应(反应前后溶液体积不变),在反应过程中,下列叙述错误的是
| A.电子由锌片经导线流向铜片 | B.铜片作正极,锌片作负极 |
| C.溶液中SO42- 的物质的量浓度保持不变 | D.溶液中Cu2+移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
蓄电池放电时是起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电、放电时的反应: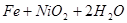

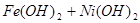 ,下列有关爱迪生电池的各种推断中错误的是( )。
,下列有关爱迪生电池的各种推断中错误的是( )。
A.放电时铁做负极, 做正极 做正极 |
B.充电时阴极上的电极反应为: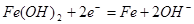 |
| C.放电时,电解质溶液中的阴离子是向正极方向移动 |
| D.蓄电池的两个电极必须浸入在碱性溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
A.甲烧杯中A极上最多可析出铜0.64g
B.甲烧杯中B极上电极反应式4OH--4e-= 2H2O+O2↑
C.烧杯中C极上电极反应式为4H+ + 4e-=2H2↑
D.乙烧杯中滴入酚酞试液,D极附近先变红
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(l1分)物质A-E都是中学化学中常见的物质,它们可以发生如下图所示的反应,其中E是蓝色溶液。
(1)在以上反应中(用序号填空),属于氧化还原反应的是____________,属于离子反应的是____________。
(2)写出反应③的离子方程式:____________________________________________。
(3)反应⑦的速率如上图,其原因可能是________________________________。
(4)从上述框图中选取电极材料和电解质溶液组成原电池,其中正极材料是________________________。负极反应为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com