
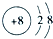 .
. .
.
分析 (1)氧离子核内有8个质子,核外有两个电子层,分别容纳2,8个电子
(2)硫化钠中存在钠离子和硫离子,钠离子直接用离子符号表示,硫离子需要标出最外层电子及所带电荷;
(3)电子层结构相同的离子,离子半径随着原子序数增大而减小;电子层不同的离子半径随电子层数的增多而增大;
(4)元素的非金属性越强,对应的最高价氧化物对应的水化合物酸性越强,本题要首先判断元素的非金属性强弱;
(5)由题干可知:淡黄色固体A是Na2O2;液体X是H2O;气体Y是SO2;气体C则为O2;溶液D显酸性是NaHSO3;
(6)①该反应为2FeCl3+Cu═2FeCl2+CuCl2,Cu做负极,石墨为正极,X为FeCl3和FeCl2溶液;
②盐桥中阳离子向正极移动
③根据转移电子的物质的量和金属阳离子的物质的量的变化确定曲线对应的离子;
④结合转移电子的物质的量计算
解答 解:(1)氧离子核内有8个质子,核外有两个电子层,分别容纳2,8个电子,离子结构示意图: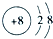 ,故答案为:
,故答案为: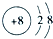
(2)Na2S为离子化合物,钠离子用离子符号表示,硫离子标出最外层电子,硫化钠的电子式为: ,
,
故答案为: ;
;
(3)电子层结构相同的离子,离子半径随着原子序数增大而减小;电子层不同的离子半径随电子层数的增多而增大,离子半径:S2->O2->Na+,故答案为:r(S2-)>r(O2-)>r(Na+);
(4)元素周期表中,同一周期元素从左到右元素的非金属性逐渐增强,则非金属性:Cl>S>Si,元素的非金属性越强,对应的最高价氧化物对应的水化合物酸性越强,故答案为:HClO4>H2SO4>H2SiO3;
(5)淡黄色固体A是Na2O2;液体X是H2O;气体Y是SO2;气体C则为O2;D溶液显酸性是NaHSO3.
①过氧化钠与水反应的要拆成离子,故答案为:2Na2O2+2H2O═4Na++OH-+O2↑;
②NaHSO3溶液呈酸性,NaHSO3溶液中存在亚硫酸氢根的水解与电离,水解导致其呈碱性,电离导致其呈酸性,据此分析:电离程度大于水解程度;故离子浓度大小为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(6))①据反应物和生成物可以确定该反应为2FeCl3+Cu═2FeCl2+CuCl2,所以X为FeCl3和FeCl2溶液,
故答案为:FeCl3和FeCl2;
②Cu做负极,石墨作正极,盐桥中阳离子向正极移动,则K+不断移向正极即进入X溶液中,
故答案为:K+;
③根据丙图可知溶液中有三种金属阳离子,而根据X的成分可知X中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,它的物质的量从零逐渐增大,③为Cu2+,①表示的金属离子的物质的量正极减少,则为Fe3+,所以②为Fe2+,
故答案为:Fe2+;
④当电子转移为2mol时,溶液中有Fe3+ 2mol,Fe2+ 3mol,Cu2+为1mol,所以需要加入NaOH溶液14mol,所以NaOH溶液等体积为14mol÷5mol•L-1=2.8L,
故答案为:2.8.
点评 本题综合考查了物质结构与性质、电解质溶液、原电池和电解原理相关知识,综合性强,难度大,主要考查学生分析问题的能力,是高考的热点习题


科目:高中化学 来源: 题型:多选题
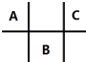 有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32.D 元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32.D 元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )| A. | 元素D形成的气态氢化物的空间结构一定是正四面体 | |
| B. | A、B 两种元素的气态氢化物均能不它们的最高价氧化物对应的水化物发生反应,且反应类型相同 | |
| C. | DB2、DC4中每个原子都满足8电子稳定结构 | |
| D. | 四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最高 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:K+、Fe2+、NO 、Cl-
、Cl-
B.0.1 mol·L-1NaHCO3溶液:Na+、Ba2+、NO 、OH-
、OH-
C.滴加KSCN溶液显红色的溶液:NH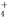 、K+、Cl-、I-
、K+、Cl-、I-
D.澄清透明的溶液中:Cu2+、K+、SO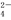 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了氧化还原反应 | |
| B. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| C. | 利用植物油的氧化反应可以获得人造脂肪 | |
| D. | 干燥剂硅胶和硅橡胶的主要成分都是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/mol | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | W点所示的溶液中:c(Na+)+c(H+)═2c(CO32-)+c(OH-)+c(Cl-) | |
| B. | pH=4的溶液中:c(H2CO3)+c(HCO32-)+c(CO32-)<0.1 mol•L-1 | |
| C. | pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)═c(OH-)+c(Cl-) | |
| D. | pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3- )>c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com