

| A. | 分子式为C16H18O9 | |
| B. | 0.1mol绿原酸最多与0.8 molNaOH反应 | |
| C. | 能发生取代反应和消去反应 | |
| D. | 能使酸性高锰酸钾溶液褪色 |
分析 由结构可知分子式,该有机物中含酚-OH、C=C、醇-OH、-COOH、-COOC及苯环等,结合醇、羧酸、酚的性质来解答.
解答 解:A.由结构简式可知,分子式为C16H18O9,故A正确;
B.酚-OH、-COOH、-COOC-能与NaOH溶液反应,则0.1mol绿原酸最多与0.4molNaOH反应,故B错误;
C.含醇-OH,且与-OH相连的邻位碳上含H,则能发生消去反应,酚-OH、醇-OH、-COOH,均可发生取代反应,故C正确;
D.含-OH、碳碳双键,均能使酸性高锰酸钾溶液褪色,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握把握有机物的官能团与性质的关系,熟悉酚、醇、羧酸的性质即可解答,侧重分析与应用力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | Ba(OH)2溶液与硫酸反应:OH-+H+═H2O | |
| C. | 次氯酸钙溶液中通入少量SO2:2ClO-+Ca2++SO2+H2O═CaSO3↓+2HClO | |
| D. | 碳酸氢钠溶液中加入过量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
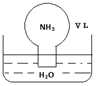 标准状况下,将体积为V L充满氨气的圆底烧瓶倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法错误的是( )
标准状况下,将体积为V L充满氨气的圆底烧瓶倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法错误的是( )| A. | 水最终会充满整个烧瓶 | |
| B. | 所得溶液的物质的量浓度为 $\frac{1}{22.4}$mol•L-1 | |
| C. | 所得溶液的质量分数为$\frac{17}{22400}$ρ | |
| D. | 将氨气换为二氧化氮,所得溶液的物质的量浓度也为$\frac{1}{22.4}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
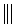 +
+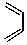 $\stackrel{△}{→}$
$\stackrel{△}{→}$ 如果要合成化合物A,其结构为:
如果要合成化合物A,其结构为: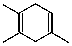 下列说法不正确的是( )
下列说法不正确的是( )| A. | 化合物A和HBr 按照物质的量1:1加成时,有三种不同的产物 | |
| B. | 该反应的原理是加成反应 | |
| C. | 合成A的原料可能是:丙炔和2,3-二甲基-1,3-丁二烯 | |
| D. | 合成A的原料可能是:2-丁炔和2-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
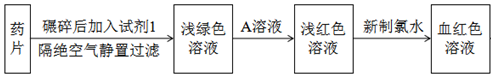
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与稀硫酸反应的离子方程式为2Na+2H+═2 Na++H2↑ | |
| B. | Na2O2溶于水产生O2:2Na2O2+2H2O=4Na++4OH-+O2↑ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀 Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 饱和碳酸钠溶液中通入过量二氧化碳气体,溶液变浑浊CO32-+CO2+H2O=HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com