
分析 A、B、C、D、F五种物质的焰色反应均为黄色,说明五种物质都含有钠元素,A、B、C、D、F与盐酸反应均生成E,E为NaCl,B还生成一种可燃气体,可燃气体是氢气,所以B为Na,无色无味气体H能使澄清石灰水变浑浊,则H为CO2,F和H也可反应生成C和另一种无色无味气体,则无色无味气体为氧气,F为Na2O2,C为Na2CO3,C、D与盐酸反应生成一种无色无味气体H,D和A可反应生成C,则D为NaHCO3,A为NaOH,以此解答该题.
解答 解:A、B、C、D、F五种物质的焰色反应均为黄色,说明五种物质都含有钠元素,A、B、C、D、F与盐酸反应均生成E,E为NaCl,B还生成一种可燃气体,可燃气体是氢气,所以B为Na,无色无味气体H能使澄清石灰水变浑浊,则H为CO2,F和H也可反应生成C和另一种无色无味气体,则无色无味气体为氧气,F为Na2O2,C为Na2CO3,C、D与盐酸反应生成一种无色无味气体H,D和A可反应生成C,则D为NaHCO3,A为NaOH,
(1)根据上面的分析可知,A、B、C、D、E、F的化学式分别为NaOH、Na、Na2CO3、NaHCO3、NaCl、Na2O2,
故答案为:NaOH、Na、Na2CO3、NaHCO3、NaCl、Na2O2;
(2)H为CO2,F为Na2O2,F和H反应的化学方程式 为2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(3)D为NaHCO3,D+盐酸反应的离子方程式:HCO3-+H+═CO2↑+H2O,
故答案为:HCO3-+H+═CO2↑+H2O;
(4 )从元素守恒可知,CO和H2组成的混合气体在足量的O2中充分燃烧后生成NaOH和Na2CO3,Na2O2固体增加的质量即为CO和H2的质量,所以Na2O2固体增加的质量=ag,
故答案为:=.
点评 本题考查无机物的推断,侧重于考查学生的综合分析能力,不但要求同学们具备有关物质的基础知识,而且要有实验操作的经历和分析、解决化学实验问题的能力.解题时需要认真分析题目给出的条件,联系实际,逐一分析推断,题目难度不大.


科目:高中化学 来源: 题型:解答题
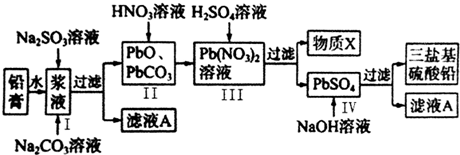
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2 CH CH2CH2CH3B | B. | (CH3 CH2)2 CHCH3 | ||
| C. | (CH3)2 CH CH (CH3)2 | D. | (CH3)3 C CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
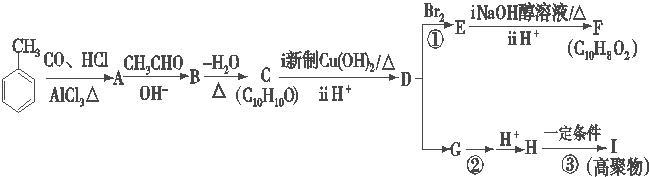
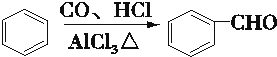
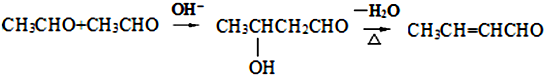
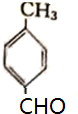 .
.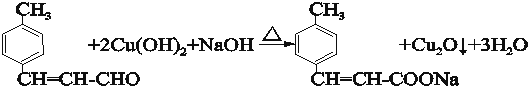 .
.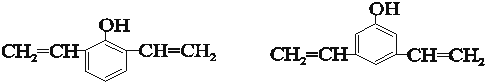 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
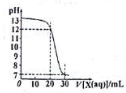 如图为用一定浓度的盐酸X滴定10mL一定浓度NaOH溶液Y的滴定图象,依据图象推出X和Y的物质的量浓度是下表内各组中的( )
如图为用一定浓度的盐酸X滴定10mL一定浓度NaOH溶液Y的滴定图象,依据图象推出X和Y的物质的量浓度是下表内各组中的( )| A | B | C | D | |
| X/mol/L | 0.09 | 0.03 | 0.04 | 0.12 |
| Y/mol/L | 0.03 | 0.09 | 0.12 | 0.04 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | Al3+ | C. | Na+ | D. | Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com