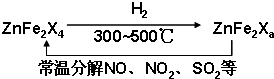W、X、Y、Z是原子序数依次增大的同一短同期的四种元素.W、X是金属元素,Y、Z是非金属元素.Y的氧化物是现代光学及光纤制品的基本原料.请回答:
(1)WZ是生活中常见的盐,实验室检验该盐中阴离子的操作方法和现象为:取少量WZ固体溶于水, ,则证明WZ中有该阴离子.
(2)Y在元素周期表中的位置是 .
(3)Z元素形成氢化物的电子式 .
(4)将W、X的氢氧化物混合,其反应的离子方程式为 .
(5)0.5mol X单质与足量W的最高价氧化物对应水化物的溶液发生反应,生成气体的体积为 (标准状况).
【答案】
分析:W、X、Y、Z是原子序数依次增大的同一短同期的四种元素,W、X是金属元素,Y、Z是非金属元素,Y的氧化物是现代光学及光纤制品的基本原料,则Y为Si,由WZ是生活中常见的盐,则W为Na,Z为Cl,结合(4)、(5)可知,X为Al,然后结合物质的性质及化学用语来解答.
解答:解:W、X、Y、Z是原子序数依次增大的同一短同期的四种元素,W、X是金属元素,Y、Z是非金属元素,Y的氧化物是现代光学及光纤制品的基本原料,则Y为Si,由WZ是生活中常见的盐,则W为Na,Z为Cl,结合(4)、(5)可知,X为Al,
(1)检验氯离子,一般利用硝酸酸化的硝酸银,产生白色沉淀证明含有氯离子,即取少量WZ固体溶于水,滴加硝酸酸化的硝酸银,观察到白色沉淀,
故答案为:滴加硝酸酸化的硝酸银,观察到白色沉淀;
(2)Y为Si,位于第三周期第ⅣA族,故答案为:第三周期第ⅣA族;
(3)Z的氢化物为HCl,其电子式为
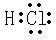
,故答案为:
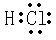
;
(4)将W、X的氢氧化物混合,其反应的离子方程式为OH
-+Al(OH)
3═AlO
2-+2H
2O,
故答案为:OH
-+Al(OH)
3═AlO
2-+2H
2O;
(5)X单质与足量W的最高价氧化物对应水化物的溶液发生反应时存在2Al~3H
2↑,则0.5molAl反应生成气体为0.5mol×

×22.4L/mol=16.8L,故答案为:16.8L.
点评:本题考查位置、结构、性质的关系及应用,明确元素在周期表中的位置及元素周期律即可解答,题目难度不大.

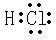 ,故答案为:
,故答案为: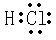 ;
; ×22.4L/mol=16.8L,故答案为:16.8L.
×22.4L/mol=16.8L,故答案为:16.8L.

 小题狂做系列答案
小题狂做系列答案 Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.