
| A. | 食盐和油都是生活必需品.加碘盐中的碘以碘化钾的形式存在;而植物油变质是由于发生了酯化反应 | |
| B. | “神十”搭载的长二F改进型火箭推进剂是偏二甲肼(C2H8N2)和四氧化二氮,其中四氧化二氮作氧化剂 | |
| C. | 镁铝合金可用作制造飞机的材料 | |
| D. | 近期正热播柴静的雾霾调查纪录片《穹顶之下》.PM2.5是灰霾天气的主要原因,是指大气中直径小于或等于2.5微米的颗粒物,也叫可入肺颗粒物,与肺癌、哮喘等疾病的发生密切相关,它主要来自化石燃料的燃烧(如机动车尾气、燃煤)等 |
分析 A.加碘盐中的碘以碘酸钾存在,植物油变质发生氧化反应;
B.发生C2H8N2+2N2O4$\frac{\underline{\;点燃\;}}{\;}$2CO2+4H2O+3N2,四氧化二氮中N元素的化合价降低;
C.镁铝合金的硬度高,密度小;
D.灰霾与固体颗粒物的排放有关.
解答 解:A.食盐和油都是生活必需品,加碘盐中的碘以碘酸钾的形式存在,而植物油(属于油脂)变质是由于发生了氧化反应,故A错误;
B.发生C2H8N2+2N2O4$\frac{\underline{\;点燃\;}}{\;}$2CO2+4H2O+3N2,四氧化二氮中N元素的化合价降低,则四氧化二氮作氧化剂,故B正确;
C.镁铝合金的硬度高,密度小,则镁铝合金可用作制造飞机的材料,故C正确;
D.灰霾与固体颗粒物的排放有关,颗粒物主要来自化石燃料的燃烧(如机动车尾气、燃煤)等,大气中直径小于或等于2.5微米的颗粒物,也叫可入肺颗粒物,与肺癌、哮喘等疾病的发生密切相关,故D正确;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握化学与生活的关系等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:解答题
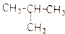 ⑥
⑥ ⑦
⑦
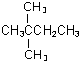 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | vA=0.5mol/(L•s) | B. | vB=0.2mol/(L•s) | C. | vC=0.9mol/(L•s) | D. | vD=1.1mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该烯烃的一种同分异构体为CH2=CHCH(CH3)2名称为2-甲基-3-丁烯 | |
| B. | 有一种同分异构体的名称为:2,2-二甲基-1-丙烯 | |
| C. | 其属于烯烃的同分异构体有5种 | |
| D. | 该物质的可能结构中最多有两个侧链 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
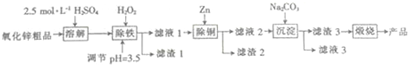
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.7 | 3.2 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9.0 |
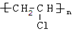 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com