


科目:高中化学 来源:2012-2013学年河北省石家庄市毕业班第二次模拟考试理综化学试卷(解析版) 题型:填空题
A、B、C、D四种物质溶于水均完全电离,电离出的离子如下表。
|
阳离子 |
Na+、Al3+、Ba2+、H+、NH4+ |
|
阴离子 |
SO42-、OH-、CO32-、Cl- |
现进行如下实验:
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为_________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a _______b(填“>”、“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为_______ (填化学式)。
(3)C溶液与D溶液反应的离子方程式为_______
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将_______ (填“正向”、“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为____________________
(5)已知沉淀甲的Ksp=x。将0.03mol·L-1的A溶液与0.01mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为_______ (用含x的代数式表示,混合后溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京市高三上学期开学测试化学试卷 题型:选择题
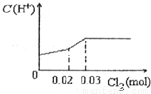
将0.03mol Cl2缓缓通入含有0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程中C(H+)与Cl2用量的关系是
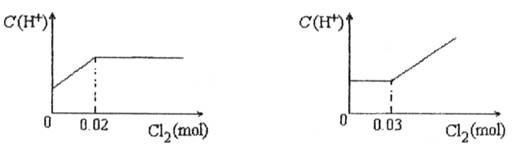
A B
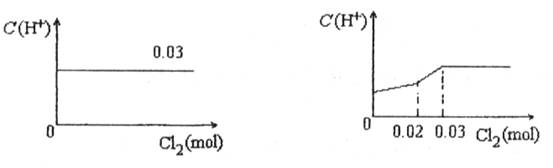
C D
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省晋中市介休十中高三(上)第三次月考化学试卷(解析版) 题型:选择题
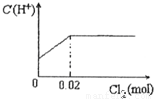
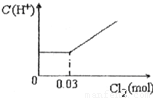

查看答案和解析>>
科目:高中化学 来源: 题型:
将0.03mol Cl2缓缓通入含有0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程中C(H+)与Cl2用量的关系是
A B
C D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com