
 ,若要检验出其中的碳碳双键,方法是先加足量的银氨溶液使醛基氧化,然后再加入酸性的KMnO4溶液,若酸性KMnO4溶液的紫色褪去,证明有碳碳双键存在.
,若要检验出其中的碳碳双键,方法是先加足量的银氨溶液使醛基氧化,然后再加入酸性的KMnO4溶液,若酸性KMnO4溶液的紫色褪去,证明有碳碳双键存在. 分析 (1)三种猜想:溴水分别与乙醛发生取代、加成及氧化,溴水与乙醛发生取代反应有HBr生成;乙醛被氧化生成乙酸和HBr,溶液均呈酸性;
(2)若发生取代反应,1molBr2可生成1molHBr;若发生加成反应,则无HBr生成;若发生氧化反应,1molBr2可被还原生成2molHBr;
(3)通过计算溶液中溴离子的物质的量结合(2)来判断反应类型,然后书写方程式;
(4)碳碳双键,醛基都能使溴水、高锰酸钾酸性溶液褪色,因此要检验柠檬醛分子结构中有碳碳双键,必须把醛基转变为不具还原性的基团;
解答 解:(1)溴水与乙醛发生取代反应有HBr生成;乙醛被氧化生成乙酸和HBr,溶液均呈酸性,所以无法检验褪色后溶液的酸碱性,确定其发生哪类反应;
故答案为:不可行;溴水与乙醛发生取代反应和乙醛被溴水氧化都有HBr生成,溶液均呈酸性;
(2)若发生取代反应,1molBr2可生成1molHBr,故反应后n(Br-)=amol;若发生加成反应,则无HBr生成,故反应后n(Br-)=0;若发生氧化反应,1molBr2可被还原生成2molHBr,故反应后n(Br-)=2amol,
故答案为:a;0;2a;
(3)得到固体3.76g为AgBr的质量,n(AgBr)=$\frac{3.76g}{188g/mol}$=0.02mol,n(Br-)=2n(Br2),则反应为氧化反应,反应方程式为:CH3CHO+Br2+H2O→CH3COOH+2HBr;
故答案为:③;CH3CHO+Br2+H2O→CH3COOH+2HBr;
(4)碳碳双键,醛基都能使溴水、高锰酸钾酸性溶液褪色,因此要检验柠檬醛分子结构中有碳碳双键,必须把醛基转变为不具还原性的基团,先加足量的银氨溶液使醛基氧化,但也不能再用溴水来检验碳碳双键,因为所得清液还可能有过量的银氨溶液,它也能使溴水褪色,且形成淡黄色浑浊,不利于现象的观察,所以先加足量的银氨溶液使醛基氧化,然后再加入酸性的KMnO4溶液,若酸性KMnO4溶液的紫色褪去,证明有碳碳双键存在;
故答案为:先加足量的银氨溶液使醛基氧化,然后再加入酸性的KMnO4溶液,若酸性KMnO4溶液的紫色褪去,证明有碳碳双键存在;
点评 本题主要考查化学实验方案的评价,题目难度中等,注意根据反应的类型判断反应可能的产物,把握实验原理是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
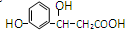 ,它不可以发生的反应类型有:①加成;②水解;③消去;④酯化;⑤银镜;⑥氧化;⑦取代;⑧加聚;⑨缩聚.( )
,它不可以发生的反应类型有:①加成;②水解;③消去;④酯化;⑤银镜;⑥氧化;⑦取代;⑧加聚;⑨缩聚.( )| A. | ①⑤⑧ | B. | ①②⑤⑨ | C. | ②⑥⑧⑨ | D. | ②⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验现象 |
| ①用砂纸摩擦后的镁带与沸水反应,再向反应 应后溶液中滴加酚酞 | A、浮于水面,熔成一个小球,在水面上无定向移 动,随之消失,溶液变红色 |
| ②钠与滴有酚酞试液的冷水反应 | B、产生气体,可在空气中燃烧,溶液变成浅红色 |
| ③镁条与2mol•L-1的盐酸反应 | C、反应不十分强烈,产生无色气体 |
| ④铝条与2mol•L-1的盐酸反应 | D、剧烈反应,产生无色气体 |
| ⑤向AlCl3溶液中滴加NaOH溶液至过量 | E、生成白色胶状沉淀,继而沉淀消失 |
| 实验方案 | 实验现象(填写序号) |
| ① | B |
| ② | A |
| ③ | D |
| ④ | C |
| ⑤ | E |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是( )| A. | 奎尼酸的分子式是C7H9O6 | |
| B. | 1mol奎尼酸与足量NaOH溶液反应,最多消耗NaOH物质的量为5mol | |
| C. | 1 mol奎尼酸与足量钠反应生成56L氢气 | |
| D. | 奎尼酸能发生消去反应,也能与乙醇、乙酸发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向豆浆中加入盐卤做豆腐 | |
| B. | 冶金厂大量烟尘用高压电除去 | |
| C. | 一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通路 | |
| D. | 向石灰水中通入二氧化碳气体产生白色浑浊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com