
【题目】如下图所示可逆反应:mA(g) + nB(g) ![]() xC(g) ΔH = Q kJ/mol;在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是
xC(g) ΔH = Q kJ/mol;在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是

A. 上述反应是放热反应
B. 上述反应是吸热反应
C. m+n<x
D. m+n>x
【答案】AD
【解析】
根据第一个图到达平衡时所用时间的长短和斜率判断压强P1和P2的相对大小,增大压强,化学平衡向气体体积减小的方向移动,由此判断反应前后气体化学计量数的相对大小;根据第二个图判断,升高温度,化学平衡向吸热方向移动,再结合A的转化率判断该反应的正反应是放热还是吸热。
A.通过观察第二个图,发现随着温度的升高,A的转化率降低,说明升温平衡逆向移动,则逆反应为吸热反应,正反应为放热反应,A正确;
B.通过观察第二个图,发现随着温度的升高,A的转化率降低,说明升温平衡逆向移动,则逆反应为吸热反应,正反应为放热反应,B错误;
C.通过观察第一个图可知在P1条件下反应速率快,先达到平衡,所以确定P1>P2;增大压强,化学平衡向气体体积减小的方向移动,由图象知增大压强,A的转化率增大,平衡向正反应方向移动,所以反应前的计量数大于反应后的计量数,即m+n>x,C错误;
D. 过观察第一个图可知在P1条件下反应速率快,先达到平衡,所以确定P1>P2;增大压强,化学平衡向气体体积减小的方向移动,由图象知,A的转化率增大,平衡向正反应方向移动,所以反应前的计量数大于反应后的计量数,即m+n>x,D正确;
正确答案:AD。


科目:高中化学 来源: 题型:
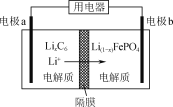
【题目】LiFePO4是一种电动汽车电池的电极材料,实验室以绿矾和磷酸为原料制备LiFePO4的流程如下:

(1)“溶解”和“反应1”步骤不能互换的原因是________。
(2)“反应1”的离子方程式是________。
(3)“反应2”是2LiOH+6H2C2O4+2FePO4===2LiFePO4+7CO2↑+5CO↑+7H2O,其中体现氧化性和还原性的反应物的物质的量之比为________。
(4)LiFePO4需要在高温下成型才能作为电极,高温成型时要加入少量活性炭黑,其作用是:①________,②________。
(5)利用LiFePO4作电极的电池稳定、安全、对环境友好,放电时工作原理如图所示。放电时电极b的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
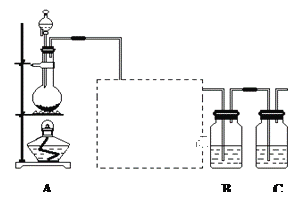
(1)装置A的分液漏斗中盛装的试剂是___________,烧瓶中加入的试剂是___________,发生的离子反应方程式_____________________;
(2)虚线框内是一个装有未知试剂的广口瓶,该试剂是___________,说明装置的作用________________;
(3)装置B中盛放的试剂是______________(选填下列所给试剂的字母),实验现象为___________________,化学反应方程式是__________________________________;
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁。可说明氯比硫非金属性强的是_________;
A.全部 B.②③④⑥ C.①②④⑤⑥ D.除①以外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应PCl5(g)![]() PCl3(g)+Cl2(g),523K时,将10mol PCl5注入容积为2L的密闭容器中,平衡时压强为原来的1.5倍。
PCl3(g)+Cl2(g),523K时,将10mol PCl5注入容积为2L的密闭容器中,平衡时压强为原来的1.5倍。
(1)该温度下该反应的平衡常数K为________
(2)PCl5的平衡转化率为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
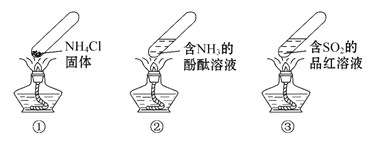
A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增大,且均不大于20。Y元素原子的最外层电子 数是内层电子数的3倍,Z元素原子的最外层电子数是最内层电子数的一半。甲是W、X两种元素形成的简单化合物,水溶液呈碱性,乙是Y元素的单质。在工业生产中它们有如下转化关系。下列叙述正确的是

A. 原子半径的大小W<X<Y<Z
B. 戊与丁反应过程中氧化剂与还原剂的物质的量之比为1:2
C. Y与Z形成的所有化合物中只存在离子键
D. X元素的氧化物对应的水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2(g) + O2(g) ![]() 2SO3(g) △H =-akJ/mol(a>0),能量变化如图所示,下列说法不正确的是
2SO3(g) △H =-akJ/mol(a>0),能量变化如图所示,下列说法不正确的是

A. 2SO2(g) +O2(g) ![]() 2SO3(1) △H>-a kJ/mol
2SO3(1) △H>-a kJ/mol
B. 过程II可能使用了催化剂,使用催化剂不可以提高SO2的平衡转化率
C. 反应物断键吸收能量之和小于生成物成键释放能量之和
D. 将2molS02(g)和1 mol 02(g)置于一密闭容器中充分反应后放出的热量小于a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2![]() O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。下列结论错误的是( )
O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。下列结论错误的是( )
A. CO与HbO2反应的平衡常数K=![]()
B. 当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
C. 人体吸入的CO越多,与血红蛋白结合的O2越少
D. 把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )
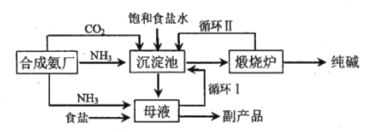
A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com