
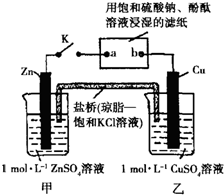
| A、电子沿Zn→a→b→Cu路径流动 |
| B、Cu电极质量增加 |
| C、甲池与乙池中的溶液互换,闭合K,电流没有明显变化 |
| D、片刻后可观察到滤纸b点变红色 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
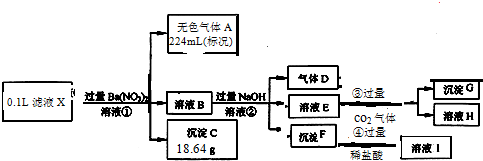
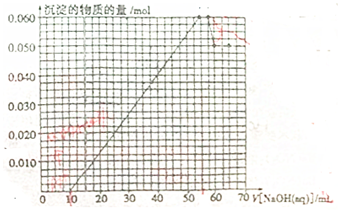
| 原溶液中确定含有的阴离子的化学式 | 该阴离子的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、NH3的水溶液都能够导电,因此都属于电解质 |
| B、电解饱和食盐水的过程中,水的电离平衡逆向移动 |
| C、任何一个氧化还原反应都可以设计为电池,输出电能 |
| D、若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO3与BaCl2溶液作用,有白色沉淀生成,加硝酸后沉淀不消失 |
| B、将SO2气体通入Ba(OH)2溶液中有白色沉淀生成 |
| C、将SO2气体通入BaCl2溶液中有白色沉淀生成 |
| D、将SO2气体通入硝酸酸化的BaCl2溶液中有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾-Al2(SO4)3?12H2O |
| B、芒硝-Na2SO4?10H2O |
| C、绿矾-FeSO4?7H2O |
| D、胆矾-CuSO4?5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2通入CaCl2溶液中 |
| B、NO2通入FeSO4溶液中 |
| C、NH3通入AlCl3溶液中 |
| D、SO2通入已酸化的Ba(NO3)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸、甲苯、硝基苯 |
| B、苯、苯酚水溶液、酒精水溶液 |
| C、乙醛、乙酸乙酯、溴苯 |
| D、淀粉粉末、蔗糖粉末、石蕊粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、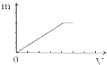 |
B、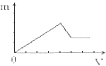 |
C、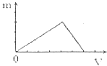 |
D、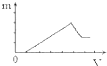 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com