���
�⣺��Ԫ��X��Y��Z��E��M��N��Ϊ����������Ԫ�أ���ԭ��������������YԪ��ԭ������������������������֮��Ϊ3��4������֪YΪOԪ�أ�MԪ����YԪ�����γɻ�����MY
2�ͻ�����MY
3��������MY
2������Ԫ������������ͬ����MΪSԪ�أ�N
-��Z
+��X
+�İ뾶��С����֪X��Z���ڢ�A�壬N���ڢ�A�壬���ԭ��������֪��ZΪNa��NΪCl��������XN�ڳ�����Ϊ���壬��XΪHԪ�أ�E��Z��N������������ˮ���������ܷ�Ӧ��Ӧ������������ǿ�ᡢǿ�Ӧ����EΪAl��
��1��Z����������ˮ����ΪNaOH���������������������ӹ��ɣ������ʽΪ��

��
�ʴ�Ϊ��

��
��2��������Ӧ��2SO
2��g��+O
2��g��?2SO
3��g����H��0��
�ٺ��º����£�������ͨ��1mol SO
2��1mol O
2���ʣ�������ͨ��1molSO
3��0.5mol O
2���ʣ����ߵõ���ͬ��ƽ��״̬��ƽ��ʱ������SO
2��ת����������SO
3�ķֽ���֮��Ϊ1�����ס�����ʼ��Ӧ�¶���ͬ�������������������������������Ϊ�¶����ߣ������¶Ƚ��ͣ������������ƽ����Ե�ЧΪ�ڼ�ƽ��Ļ����Ͻ����¶ȣ���������ķֽ��ʱ�����е��¶ȵ���ƽ��ķֽ��ʵͣ���ƽ��ʱ������MY
2��ת����Ϊa������MY
3�ķֽ���Ϊb����a+b��1��
�ʴ�Ϊ������
��A��v
����Y
2��=2v
����MY
3��������֮�Ȳ����ڻ�ѧ������֮�ȣ���ӦΪ����ƽ�⣬��A����
B�����������£����������ܶ�ʼ�ղ��䣬��B����
C��ƽ��ʱ�������������������Ũ����ת�����йأ�ƽ��ʱ����Ũ�Ȳ�һ����ȣ���C����
D���淴Ӧ���������ʵ�����С���������������ʵ������䣬˵������ƽ�⣬��D��ȷ��
E�����������£����������¶����ߣ��������¶Ȳ��䣬˵������ƽ�⣬��E��ȷ��
F��SO
2��O
2����ʼ���ʵ���֮�Ȳ����ڻ�ѧ������֮�ȣ������������淴Ӧ���з����仯���ʶ��������Ȳ��䣬˵������ƽ��״̬����F��ȷ��
�ʴ�Ϊ��DEF��
��3��2.7��Al�����ʵ���Ϊ0.1mol��100ml 2mol/L NaOH��Һ��n��NaOH��=0.1L��2mol/L=0.2mol�����߷�����Ӧ��2Al+2NaOH+2H
2O=2NaAlO
2+3H
2�����ɷ���ʽ��֪0.1molAl��ȫ��Ӧ����0.1molNaOH����ʣ��0.1molNaOH������0.1molNaAlO
2����Ӧ�����Һ�е���2mol/L HCl����Һ������Һ�в���3.9�˳���Ϊ��������������������Һ��AlԪ��ȫ��ת��Ϊ��������������������������=0.1mol��78g/mol=7.8g��3.9g����AlԪ��û��ȫ�������������������һ������㣬ֻ�в���ƫ������ת�����������������������������ƫ��������ȫת��Ϊ�������������������������ܽ⣬
3.9g�������������ʵ���=
=0.05mol��
������㣬ֻ�в���ƫ������ת������������������
NaOH+HCl=NaCl+H
2O
0.1mol 0.1mol
NaAlO
2+HCl+H
2O=Al��OH��
3��+NaCl��
0.05mol 0.05mol
��HCl�����ʵ���=0.1mol+0.05mol=0.15mol��������������=
=0.075L=75mL��
�����������ƫ��������ȫת��Ϊ�������������������������ܽ⣬��
NaOH+HCl=NaCl+H
2O
0.1mol 0.1mol
NaAlO
2+HCl+H
2O=Al��OH��
3��+NaCl��
0.1mol 0.1mol 0.1mol
Al��OH��
3+3HCl=AlCl
3+3H
2O
��0.1-0.05��mol 3����0.1-0.05��mol
��HCl�����ʵ���=0.1mol+0.1mol+3����0.1-0.05��mol=0.35mol��������������=
=0.175L=175mL��
�ʴ�Ϊ��75mL��175mL��
��4����2CH
3OH��l��+3O
2��g���T2CO
2��g��+4H
2O��g����H=-akJ?mol
-1��2CO��g��+O
2��g���T2CO
2��g����H=-bkJ?mol
-1��H
2O��g���TH
2O��l����H=-ckJ?mol
-1���ݸ�˹���ɣ�
[��-��]+2���۵�CH
3OH��I��+O
2��g���TCO��g��+2H
2O��l�������H=
��[��-akJ?mol
-1��-��-bkJ?mol
-1��]+2����-ckJ?mol
-1��=��0.5b-0.5a-2c��kJ?mol
-1��
�ʴ�Ϊ����0.5b-0.5a-2c��kJ?mol
-1��
���ݸ�˹���ɼ��㣻
��5����ԭ��ظ�������������Ӧ���״��ڸ����ŵ磬��������������̼�����ˮ�������缫��ӦʽΪ��CH
3OH-6e
-+8 OH
-=CO
32-+6H
2O��
�ʴ�Ϊ��CH
3OH-6e
-+8 OH
-=CO
32-+6H
2O��
�ڿ�ʼ����ΪCl
-������ΪCu
2+�ŵ磬���һ��ʱ��������ռ�����ͬ�������ͬ�����������壬˵������Cu
2+��ȫ�ŵ��H
+�����ŵ磬����Һ��H
+Ũ����Cl
-Ũ�ȣ���2Cl
--2e
-=Cl
2����Cu
2++2e
-=Cu��2H
++2e
-=H
2�������ݵ���ת���غ㣬Cl
-�ŵ����ʱ��H
+û����ȫ�ŵ磬�������С�����������Ҫʹ�����õ����������ȣ���ʱ����ˮ��������һ�������������ӷŵ磬��ʱ�����缫��ӦʽΪ��4OH
--4e
-=O
2��+2H
2O��
�ʴ�Ϊ��4OH
--4e
-=O
2��+2H
2O��

 ��
�� ��
��


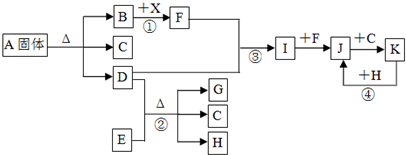
 A��B��C��D��X��Ϊ��ѧ��ѧ���������ʣ�����֮�������ͼ��ʾת����ϵ��ͼ�з�Ӧ������ȥ��
A��B��C��D��X��Ϊ��ѧ��ѧ���������ʣ�����֮�������ͼ��ʾת����ϵ��ͼ�з�Ӧ������ȥ��

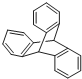 ����ʽ��
����ʽ��