
分析 (1)各元素的摩尔质量以g/mol为单位,数值上等于其相对原子质量,根据n=$\frac{m}{M}$计算各元素物质的量之比;
(2)由平均摩尔质量=$\frac{m}{n}$来计算,由质量和物质的量的关系列方程解出甲烷的物质的量,再计算混合气体中甲烷的体积和一氧化碳的质量;
(3)设分解后生成Am,则有2mAH3$\frac{\underline{\;一定温度\;}}{\;}$2Am+3mH2,根据反应前后物质的量的关系计算.
解答 解:(1)0.8gCa、0.3gMg、0.2gCu、0.01gFe的物质的量之比=$\frac{0.8g}{40g/mol}$:$\frac{0.3g}{24g/mol}$:$\frac{0.2g}{64g/mol}$:$\frac{0.01g}{56g/mol}$=224:140:35:2,故答案为:224:140:35:2;
(2)标准状况下,8.96L气体的物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,设甲烷的物质的量为x,CO的物质的量为y,
则$\left\{\begin{array}{l}{x+y=0.4mol}\\{16x+28y=7.6g}\end{array}\right.$,解得x=0.3mol,y=0.1mol,
混合气体平均摩尔质量为$\frac{7.6g}{0.4mol}$=19g/mol,
混合气体中甲烷的体积为0.3mol×22.4mol/L=6.72L,一氧化碳的质量为:0.1mol×28g/mol=2.8g,
故答案为:19;6.72L;2.8g;
(3)设分解后生成Am,则有2mAH3$\frac{\underline{\;一定温度\;}}{\;}$2Am+3mH2,此时密闭容器的体积变为原来的$\frac{7}{4}$,则有$\frac{2+3m}{2m}$=$\frac{7}{4}$,解得m=4,
可得反应的方程式为4AH3$\frac{\underline{\;一定温度\;}}{\;}$A4↑+6H2↑,
故答案为:4;4AH3$\frac{\underline{\;一定温度\;}}{\;}$A4↑+6H2↑.
点评 本题考查物质的量的相关计算,题目难度中等,注意把握相关计算公式的运用,为解答该题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 碘酒能消毒是利用碘的还原性 | |
| B. | 葡萄糖注射液不能产生丁达尔效应,不属于胶体 | |
| C. | 14C可用于文物的年代鉴定,14C与12C互为同素异形体 | |
| D. | 某溶液中加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | c2 | c3 | c3 |
| 4 | C1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
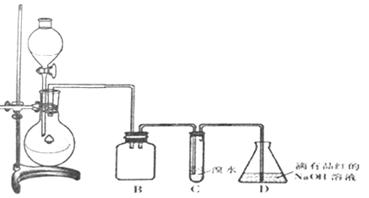
| 实验序号 | 实验操作 | 现象 | 可能的情况 |
| ① | 滴加少量淀粉-KI溶液,振荡 | III | |
| ② | 滴加少量溴水,振荡 | II | |
| ③ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{4}(C)•{c}^{2}(D)}{{c}^{3}(A)•{c}^{2}(B)}$ | |
| B. | 此时,B的平衡转化率是40% | |
| C. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 | |
| D. | 增大B,平衡向右移动B的平衡转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3a+b-c | B. | c+3a-b | C. | a+b-c | D. | c+a-b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 | B. | 16 | C. | 4 | D. | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
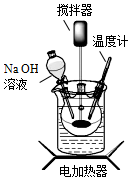 超细Fe3O4粉体可制成磁流体,一种制备超细Fe3O4粉体的实验步骤如下:
超细Fe3O4粉体可制成磁流体,一种制备超细Fe3O4粉体的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热煮沸的主要目的是除去溶液中溶解的氯气 | |
| B. | 稀释过程中用到的玻璃仪器主要有烧杯、玻璃棒、胶头滴管 | |
| C. | 滴定过程中可用KSCN溶液作指示剂 | |
| D. | 铁矿石中铁的质量分数为70% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com