
| A. | 常温常压下,8g CH4含有5NA个电子 | |
| B. | 标准状况下,22.4L氦气含有2NA个原子 | |
| C. | 常温常压下,22.4L CO2和SO2混合气体含有2NA个氧原子 | |
| D. | 46gNO2和N2O4的混合气体含氮原子数可能为1.5NA个 |
分析 A、求出甲烷的物质的量,然后根据甲烷中含10个电子来分析;
B、求出氦气的物质的量,然后根据氦气为单原子分子来分析;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、NO2和N2O4的最简式均为NO2.
解答 解:A、8g甲烷的物质的量为0.5mol,而甲烷中含10个电子,故0.5mol甲烷中含5NA个电子,故A正确;
B、标况下22.4L氦气的物质的量为1mol,而氦气为单原子分子,故含NA个氦原子,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L混合气体的物质的量小于1mol,则含有的氧原子的个数小于2NA个,故C错误;
D、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,故含氮原子为NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、Br2 |
| ③ | MnO2… | Cl2、Mn2+… |
| A. | 第①组反应的其余产物为H2O | |
| B. | 第③组反应中生成1mol Cl2,转移电子4mol | |
| C. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 | |
| D. | 第②组反应中Cl2与 FeBr2的物质的量之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  图除去CO2中的HCl | |
| B. |  图装置制备Fe(OH)2并能较长时间观察其颜色 | |
| C. |  图所示装置制取并收集干燥纯净的NH3 | |
| D. | 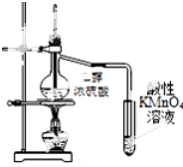 图证明CH3CH2OH发生消去反应生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.1 mol•l-1 | B. | 1.5mol•L-1 | C. | 2.4 mol•L-1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3、NaCl、K2SO4 | B. | KCl、NaOH、CuSO4 | ||
| C. | BaCl2、NaOH、H2SO4 | D. | FeCl3、Na2SO4、KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液与NaOH溶液混合 | B. | NH4Cl溶液与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与石灰乳混合 | D. | Na2HPO4溶液与NaOH溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加三聚氰胺提高牛奶的含氮量 | |
| B. | 用苏丹红(色素)作食品着色剂 | |
| C. | 加小苏打(NaHCO3)作馒头的膨松剂 | |
| D. | 用含有甲醇(CH3OH)的工业酒精兑制饮用白酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发的氧化还原反应不可以设计成原电池 | |
| B. | 将反应 3Cu+8HNO3═3Cu(NO3)2+2NO+4H2O 设计成原电池,其正极反应为:2NO3-+6e-+8H+═2NO+4H2O | |
| C. | 铅蓄电池工作时,正极、负极质量均增加 | |
| D. | 氢氧燃料电池耗H20.1mol时,电路中流经的电子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com