
【题目】科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知在常温常压下:
①2CH3OH(l) + 3O2 (g) = 2CO2(g) + 4H2O(g) H1= – 1276.0 kJ/mol
②2H2(g) + O2(g) = 2H2O(g) H2 = – 482.0 kJ/mol;
③H2O(g) = H2O(l) H3= – 44.0 kJ/mol
(1)写出由CO2和H2合成甲醇和液态水的热化学方程式______________________。
(2)在容积为2 L的密闭容器中,通入2mol CO2和5mol H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示;
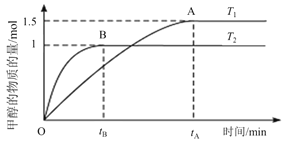
①T1 ______T2(填“<,>或=”),处于A点的反应体系从T1变到T2,达到平衡时![]() _______(填“增大,减小或不变”)。
_______(填“增大,减小或不变”)。
②若在T2温度下5 min达到化学平衡,求平衡时用H2表示的平均反应速率为![]() ______。
______。
(3)某实验小组依据甲醇燃烧的反应原理,设计下图所示的电池装置:
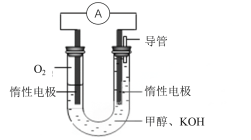
①写出电池负极的电极反应式:_____________________________________,该电池工作一段时间,测得溶液的pH________(填“增大,减小或不变”)。
②写出该电池总反应的离子方程式为________________________________________。
【答案】CO2 (g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=– 129 kJ·mol-1 < 增大 0.3 mol·L-1·min-1 CH3OH -6e + 8OH-=CO32-+6H2O 减小 2CH3OH+3O2 + 4 OH-=2CO32-+6 H2O
【解析】
(1)根据盖斯定律进行计算;
(2)①由于该反应是放热反应,所以升高温度,平衡逆向移动,甲醇的含量降低,因此温度T2>T1,处于A点的反应体系从T1变到T2,因为温度从T1升高到T2时,平衡逆向移动,故氢气的物质的量增大,甲醇的物质的量减小,故n(H2)/n(CH3OH)增大;
②根据速率的计算公式进行计算;
(3)在甲醇燃料电池中,负极失电子发生氧化反应,正极得电子发生还原反应,电解质溶液为碱性,总反应方程式为:2CH3OH+3O2+4OH-=2CO32-+6H2O。
(1)已知在常温常压下:①2CH3OH(l) +3O2 g)=2CO2(g)+4H2O(g) H1=–1276.0kJ/mol;②2H2(g)+O2(g)=2H2O(g) H2 =–482.0kJ/mol;③H2O(g)=H2O(l) H3=–44.0kJ/mol,根据盖斯定律由CO2和H2合成甲醇和液态水的热化学方程式为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=3/2H2+H3-1/2H1=(–482.0)×3/2+(–44.0)-(–1276.0)×1/2=-129kJ·mol-1,故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=–129kJ·mol-1。
(2)①由于该反应是放热反应,所以升高温度,平衡逆向移动,甲醇的含量降低,因此温度T2>T1,处于A点的反应体系从T1变到T2,因为温度从T1升高到T2时,平衡逆向移动,故氢气的物质的量增大,甲醇的物质的量减小,故n(H2)/n(CH3OH)增大,故答案为:<,增大。
②依据图像分析,若在T2温度下达到化学平衡时,甲醇的物质的量为1mol,依据化学方程式为:CO2+3H2=CH3OH+H2O,甲醇物质的量的变化量为1mol,则消耗氢气的物质的量为3mol,平衡时用H2表示的平均反应速率为3mol÷2L÷5min=0.3mol·L-1·min-1,故答案为:0.3mol·L-1·min-1。
(3)在甲醇燃料电池中,燃料在负极失电子发生氧化反应,电解质溶液为碱性,负极的方程式为:CH3OH-6e+8OH-=CO32-+6H2O,电池工作一段时间后,氢氧根离子被消耗,所以溶液的pH减小,故答案为:CH3OH-6e+8OH-=CO32-+6H2O,减小。
由燃料电池是原电池的一种,负极失电子发生氧化反应,正极得电子发生还原反应,电解质溶液为碱性,总反应方程式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 硅酸钠溶液与盐酸的反应:Na2SiO3+2H+===H2SiO3↓+2Na+
B. 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O===3I2+6OH-
C. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
D. 向NaHCO3溶液中滴加少量Ba(OH)2溶液:Ba2++OH-+HCO3—===BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类研究氢能源从未间断过,而热化学循环分解水制 H2是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为H2和O2,这是一种节约能源、节省反应物料的技术,下图是热化学循环制氢气的流程:
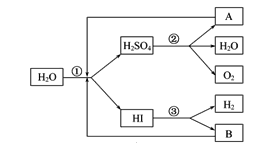
(1)实验测得,1 g H2燃烧生成液态水放出142.9 kJ的热量,则表示氢气燃烧热的热化学方程式为_______。
(2)整个流程参与循环的物质是________和________(填化学式),最难进行的反应是____________(填序号)。
(3)汞虽然有毒,但用途广泛。用汞和溴化钙作催化剂,可以在较低温度下经过下列反应使水分解制氢气和氧气:①CaBr2+2H2O=Ca(OH)2+2HBr↑;②……③HgBr2+Ca(OH)2=CaBr2+HgO+H2O;④2HgO=2Hg+O2↑。反应②的化学方程式为________________________。
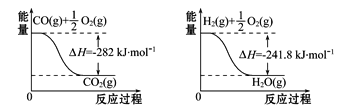
(4)合成氨用的H2可以甲烷为原料制得。有关化学反应的能量变化如图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________。
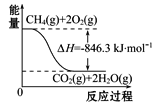
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】mA(g)+nB(g) ![]() pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是:( )
pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是:( )
①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变⑤反应速率VA:VB:VC:VD=m:n:p:q ⑥单位时间内m mol A断键反应,同时p mol C也断键反应
A. ③④⑤⑥ B. ②③④⑥ C. ①③④⑤ D. ①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着环境污染的加重和人们环保意识的加强,生物降解材料逐渐受到了人们的关注。以下是PBA (—种生物降解聚酯高分子材料)的合成路线:

己知:①烃A的相对分子质量为84,核磁共振氢谱显示只有1组峰,不能使溴的四氯化碳溶液褪色。
②化合物C中只含一个官能团。
③R1CH=CHR2![]() R1COOH+R2COOH
R1COOH+R2COOH
④
(1)由A生成B的反应类型为_________。
(2)由B生成C的化学方程式为__________。
(3)E的结构简式为______________________。
(4)F的名称为______________(用系统命名法);由D和生成PBA的化学方程式为_______________;若PBA的平均聚合度为70,则其平均相对分子质量为___________。
(5)E的同分异构体中能同时满足下列条件的共有_____种(不含立体异构)。
①链状化合物 ②能发生银镜反应 ③氧原子不与碳碳双键直接相连
其中,核磁共振氢谱显示为2组峰,且峰面积比为2:1的是_________(写结构简式)。
(6)若由1.3—丁二烯为原料(其他无机试剂任选)通过三步制备化合物F,其合成路线为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
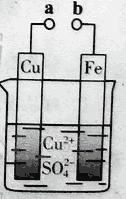
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
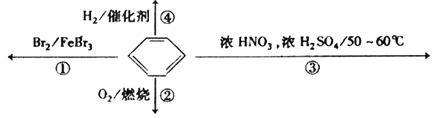
A. 反应![]() 为取代反应,有机产物的密度比水小
为取代反应,有机产物的密度比水小
B. 反应![]() 为取代反应,有机产物是一种烃
为取代反应,有机产物是一种烃
C. 反应![]() 中1mol苯最多与
中1mol苯最多与![]() 发生加成反应,是因为苯分子含有三个碳碳双键
发生加成反应,是因为苯分子含有三个碳碳双键
D. 反应![]() 为氧化反应,反应现象是火焰明亮并带有较多的黑烟
为氧化反应,反应现象是火焰明亮并带有较多的黑烟
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com