
请回答有关滴定过程中的相关问题。
(1)用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸,滴定曲线如图所示。

①在图中A的pH范围使用的指示剂是________;
C的pH范围使用的指示剂是________。
②下列关于上述中和滴定过程中的操作,正确的是________(填序号)。
A.用碱式滴定管量取已知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待装液润洗
C.滴定过程中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量筒量取
(2)如图1表示用相同浓度的NaOH溶液分别滴定浓度相同的3种一元酸,由图可确定酸性最强的是________。如图2表示用相同浓度的硝酸银标准溶液分别滴定浓度相同的含Cl-、Br-及I-的混合溶液,由图可确定首先沉淀的是 _____。

科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第1讲物质组成性质分类练习卷(解析版) 题型:填空题
铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,化学式为Cu2(OH)2CO3,“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿……→铜”的转化。

(1)从三种不同分类标准回答,“铜绿”属于哪类物质?
________、________、________。
(2)请写出铜绿与盐酸反应的化学方程式_________________________________。
(3)写出B的化学式________。
(4)上述转化过程中属于化合反应的是________,属于复分解反应的是________。
(5)胶体铜在电子行业、塑料和陶瓷电镀等方面应用广泛。下列关于溶液和胶体的叙述,正确的是________。
A.一束光线分别通过溶液和胶体时,后者能看到一条光亮的“通路”,前者则没有
B.溶液是电中性的,胶体是带电的
C.溶液中溶质分子可以通过滤纸,胶体中分散质粒子则不能通过滤纸
D.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第10讲金属元素化合物练习卷(解析版) 题型:选择题
某氧化物X难溶于水,能与烧碱反应,生成易溶于水的化合物Y,将少量Y溶液滴入盐酸中无沉淀生成,则X是( )。
A.SiO2 B.Al2O3
C.MgO D.CuO
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题8电化学原理练习卷(解析版) 题型:填空题
(1)[2013·四川理综,11(4)]以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2该电池反应的化学方程式是______________________________。
(2)[2013·重庆理综,11(2)]化学在环境保护中起着十分重要的作用,催化反硝化学法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3—的原理如图所示。

①电源正极为__________(填A或B),阴极反应式为__________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为__________克。
(3)[2013·新课Ⅱ,36(1)]锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造如图所示。

回答下列问题:
普通锌锰电池放电时发生的主要反应为
Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是________,正极发生的主要反应是_____________________________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题8电化学原理练习卷(解析版) 题型:选择题
利用如图装置可以模拟铁的电化学防护。下列叙述正确的是 ( )。

A.铁被腐蚀过程实质是金属铁发生了还原反应
B.若X为锌片,开关K置于M处,可减缓铁的腐蚀
C.若X为碳棒,开关K置于M处,可减缓铁的腐蚀
D.当K置于N处时,可减缓铁的腐蚀
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题7电解质溶液练习卷(解析版) 题型:选择题
常温下,0.1 mol·L-1 HX溶液的pH=1,0.1 mol·L-1 CH3COOH溶液的pH=2.9。下列说法不正确的是( )。
A.HX和CH3COOH均可抑制水的电离
B.取HCl与HX各0.1 mol溶于水配制成1 L混合溶液,则溶液的c(H+)=0.2 mol·L-1
C.等物质的量浓度、等体积的HX溶液与CH3COONa溶液混合后所得的溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.向等物质的量浓度、等体积的HX溶液和CH3COOH溶液中,分别加入一定物质的量浓度的NaOH溶液,欲使两者的pH均等于7,则消耗氢氧化钠溶液的体积:前者大于后者
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题6化学反应速率和化学平衡练习卷(解析版) 题型:填空题
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
实验 编号 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
1 | 130 ℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
2 | 180 ℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 |
| 0.15 |
(1)开展实验1和实验2的目的是______________________________。
(2)180 ℃时,反应到40 min,体系________(填“是”或“否”)达到平衡状态,理由是__________________________;
CH4的平衡转化率为________。
(3)已知130 ℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
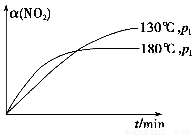
(4)一定条件下,反应时间t与转化率α(NO2)的关系如图所示,请在图像中画出180 ℃时,压强为p2(设压强p2>p1)的变化曲线,并做必要的标注。
(5)根据已知求算:ΔH2=________。
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题5化学反应与能量变化练习卷(解析版) 题型:选择题
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量。下列叙述正确的是 ( )。
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)===2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1
C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1
D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题2常用化学计量--物质的量练习卷(解析版) 题型:选择题
物质的量为0.10 mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为( )。
A.3.2 g B.4.0 g C.4.2 g D.4.6 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com