
 HN03和 HN02是氮的两种重要含氧酸.HN02能被常见的氧化剂(如高锰酸钾、重铬酸钾等)氧化;在酸性条件下也能被亚铁离子、碘离子还原;亚硝酸银( AgN02 )是一种难溶于水、易溶于酸的化合物.回答下列问题:
HN03和 HN02是氮的两种重要含氧酸.HN02能被常见的氧化剂(如高锰酸钾、重铬酸钾等)氧化;在酸性条件下也能被亚铁离子、碘离子还原;亚硝酸银( AgN02 )是一种难溶于水、易溶于酸的化合物.回答下列问题:分析 (1)元素高价氧化物的水化物(含氧酸)酸性强,低价态氧化物的水化物(含氧酸)酸性较弱,高氯酸(HClO4)的酸性比HCl0强,据此类推氮的含氧酸酸性强弱;
(2)亚硝酸钠溶液中滴入酸性高锰酸钾溶液发生氧化还原反应,该反应中锰元素化合价由+7价变为+2价,N元素化合价由+3价变为+5价,结合元素守恒、得失电子守恒书写离子反应方程式;亚硝酸钠和食盐均为白色固体,但在酸性条件下,亚硝酸钠具有氧化性,亚硝酸钠为强碱弱酸盐,亚硝酸银不溶于水,据此分析解答;
(3)氯气具有氧化性,亚硝酸根离子具有还原性,两者发生氧化还原反应生成硝酸根离子和氯离子,据此书写离子反应方程式;
(4)①常温下,铁、铝和浓硝酸、浓硫酸发生钝化现象;
②碳单质和浓硝酸加热反应生成二氧化氮、二氧化碳和水,元素化合价升高后的产物为氧化产物,结合电子守恒分析解答.
解答 解:(1)HCl04(氯元素化合价为+7价)为强酸,HCl0(氯元素化合价为+1价)为弱酸,H2S04(硫元素化合价为+6价)为强酸,H2S03(硫元素化合价为+4价)为弱酸,由此推知:HN03(氮元素化合价为+5价)为强酸,HN02(氮元素化合价为+3价)为弱酸,
故答案为:弱;
(2)该反应中Mn元素化合价由+7价变为+2价,所以MnO4-是氧化剂,NO2-作还原剂,亚硝酸根离子中N元素应该失电子化合价升高,酸性条件下,被氧化成硝酸根离子,根据转移电子相等、原子守恒配平方程式为:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O,
A.用硝酸银和硝酸溶液区别,加入AgNO3溶液,均生成白色沉淀,但亚硝酸银能溶于硝酸,AgCl不溶,现象不同,可区别,故A选;
B.测定相同物质的量浓度溶液的pH,中性的为NaCl,碱性的为亚硝酸钠,可区别,故B选;
C.甲基橙的变色范围为3.1~4.4,食盐水的PH为7,亚硝酸钠为强碱弱酸盐,溶液呈碱性,两者PH都不在甲基橙的变色范围,所以现象相同,不可区别,故C不选;
D.在酸性条件下加入KI淀粉溶液,能与亚硝酸钠反应生成碘,溶液变蓝,而NaCl不反应,能鉴别,故D选;
故答案为:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O;ABD;
(3)往氯水中滴入亚硝酸钠溶液,发现氯水褪色,说明氯气参加反应,氯气具有氧化性,亚硝酸根离子具有还原性,两者发生氧化还原反应Cl2+NO2-+H2O=2H++2Cl-+NO3-,
故答案为:Cl2+NO2-+H2O=2H++2Cl-+NO3-;
(4)①常温下,铁、铝和浓硝酸、浓硫酸发生钝化现象,使铁表面生成一层致密的氧化物薄膜而阻止进一步反应,所以可保护内部不被腐蚀,所以该原电池,铜失去电子作负极被腐蚀,故该同学设计的实验不合理,
故答案为:不合理;浓硝酸能使铁钝化,铜作负极,铁作正极,铜被腐蚀;
②碳单质和浓硝酸加热反应生成二氧化氮、二氧化碳和水,反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,该反应中C元素化合价由0价变为+4价、N元素化合价由+5价变为+4价,所以碳作还原剂、硝酸作氧化剂,转移电子数是4,CO2为氧化产物,所以每生成1mol氧化产物,转移电子的物质的量为4mol,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;4mol.
点评 本题考查了含氮化合物的性质实验,侧重氧化还原反应性质实验的考查,难点是氧化还原性质实验的评价,理清反应原理与实验目的间的关系是解答关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 22.60 |
| 第二次 | 20.00 | 1.00 | 24.50 |
| 第三次 | 20.00 | 2.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y和 Z的原子半径大小顺序为 Y>Z>X | |
| B. | Z和 Y组成的化合物中一定既有离子键又有共价键. | |
| C. | 元素 X、Y、W各自最高和最低化合价的代数和分别为 0、4、4 | |
| D. | 同时含有 X、Y、Z、W四种元素的两种不同化合物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
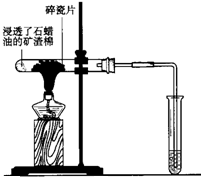 如图所示,将浸透了石蜡油的(17个碳原子以上的液态烷烃混合物)的石棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面发生反应,生成一定量的气体.利用该气体进行实验:
如图所示,将浸透了石蜡油的(17个碳原子以上的液态烷烃混合物)的石棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面发生反应,生成一定量的气体.利用该气体进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com