
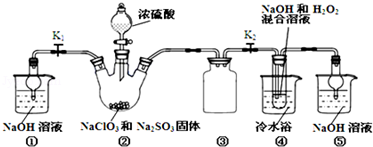
分析 装置①用碱吸收反应产生的ClO2等尾气;关闭K1,装置②中发生反应:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O,生成ClO2气体,ClO2气体经装置③进入装置④,发生反应:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,得NaClO2溶液,经蒸发结晶、过滤、洗涤、干燥等操作,得晶体NaClO2•3H2O.
(1)亚硫酸钠具有还原性,在反应中作还原剂;结合原子守恒可知,还有水生成,配平书写方程式;装置④中气体反应,装置内压强降低,装置③防止倒吸;
(2)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤;用38-60℃的温水洗涤;
(3)配制溶液的定量仪器是容量瓶,容量瓶要指明规格;
(4)有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2---2I2--4S2O32-,n(ClO2-)=$\frac{1}{4}$n(S2O32-)=$\frac{1}{4}$×20×10-3×2=0.01mol,m(NaClO2)=0.01×90.5=9.05g,计算得到样品中NaClO2的质量分数;
(5)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,消毒效率分别为$\frac{m}{67.5}$×5、$\frac{m}{166}$×3、$\frac{m}{71}$×2×1.
解答 解:(1)根据反应物NaClO3、Na2SO3、H2SO4,生成物为ClO2和2Na2SO4,配平方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O;装置③为安全瓶,防止装置②中气体温度降低而产生倒吸,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O;防止倒吸;
(2)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤;用38-60℃的温水洗涤,
故答案为:B;E;
(3)将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是250mL容量瓶,容量瓶要指明规格,则选择250mL容量瓶,
故答案为:250mL容量瓶;
(4)有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,滴入最后一滴Na2S2O3标准液,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2---2I2--4S2O32-
n(ClO2-)=$\frac{1}{4}$n(S2O32-)=$\frac{1}{4}$×20×10-3×2=0.01mol
m(NaClO2)=0.01×90.5=9.05g,
计算得到样品中NaClO2的质量分数=$\frac{9.05g}{10g}$×100%=90.5%;
故答案为:滴入最后一滴Na2S2O3标准液由蓝色变为无色且半分钟内不变色;90.5%;
(5)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率分别消毒效率分别为$\frac{m}{67.5}$×5、$\frac{m}{166}$×3、$\frac{m}{71}$×2×1,所以由大到小的顺序为ClO2>Cl2>Na2FeO4,
故答案为:ClO2;Cl2;Na2FeO4.
点评 本题考查了物质制备方法和实验设计,步骤理解应用,为高考常见题型,掌握物质性质和实验基本操作是解题关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 中和热测定实验用的小烧杯和物质的量浓度溶液配制用的容量瓶都必须干燥 | |
| B. | 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,若滴定终点时仰视读数,测得氢氧化钠浓度偏低 | |
| C. | 配制2.0 mol•L-1的硫酸,若定容时俯视,则所得溶液浓度偏高(其他操作均正确) | |
| D. | 用铜电极电解2.0 mol•L-1的硫酸,阴阳两极生成气体的体积之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
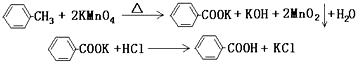
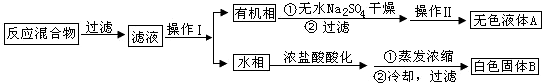
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低温、高压、催化剂 | B. | 低温、低压、催化剂 | ||
| C. | 高温、高压、催化剂 | D. | 适宜温度、高压、催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1820 | 2750 | 11600 |
| A. | 元素X的常见化合价是+3 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氯元素形成化合物时,化学式可能是XCl2 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 卤族元素是典型的非金属元素,单质及其化合物在工农业生产和生活中有重要的用途.
卤族元素是典型的非金属元素,单质及其化合物在工农业生产和生活中有重要的用途. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com