
| A. | ①⑥ | B. | ①②③④⑥ | C. | ①②③⑥ | D. | ①②③④⑦ |
分析 玻璃中含有二氧化硅,只要能和二氧化硅反应的药品不能盛放在带有玻璃塞的试剂瓶中,据此分析解答.
解答 解:①NaOH与二氧化硅反应生成粘性的硅酸钠,导致玻璃塞和试剂瓶粘结在一起而打不开,所以氢氧化钠溶液需放在带橡胶塞的玻璃试剂瓶中;
②Na2SiO3溶液由于弱酸阴离子水解导致溶液显示碱性,可以和玻璃的成分二氧化硅之间反应,所以盛放Na2SiO3等溶液的试剂瓶应用橡皮塞;
③Na2S水解显碱性,与二氧化硅反应,所以Na2S需放在带橡胶塞的玻璃试剂瓶中;
④Na2CO3水解显碱性,与二氧化硅反应硅酸钠和水,所以Na2CO3需放在带橡胶塞的玻璃试剂瓶中;
⑤NH4Cl溶液弱碱阳离子水解导致溶液显示酸性,酸性溶液与玻璃成分不反应,可以存放在玻璃塞的试剂瓶中;
⑥石灰水与二氧化硅反应硅酸钙和水,所以石灰水需放在带橡胶塞的玻璃试剂瓶中;
⑦浓H2SO4溶液显示酸性,酸性溶液与玻璃成分不反应,可以存放在玻璃塞的试剂瓶中.
故选B.
点评 本题主要考查的是试剂的存放以及盐类水解原理的应用,题目难度中等,侧重对学生灵活运用基础知识解决实际问题的能力的培养.


科目:高中化学 来源: 题型:解答题
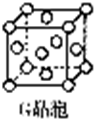 现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.G2E是红色固体.请回答下列问题:
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.G2E是红色固体.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
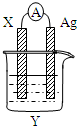 依据氧化还原反应2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.回答下列问题.
依据氧化还原反应2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 X>Y>Z | |
| B. | 非金属性 X>Y>Z | |
| C. | X、Y、Z的单质与氢气化合能力由弱到强 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 手机电池在充电时,电能转变为化学能 | |
| B. | 绿色植物进行光合作用时,太阳能主要转化为化学能 | |
| C. | 煤燃烧时,化学能主要转化为热能 | |
| D. | 白炽灯工作时,电能全部转化为光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①④⑥ | C. | ③④ | D. | ④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
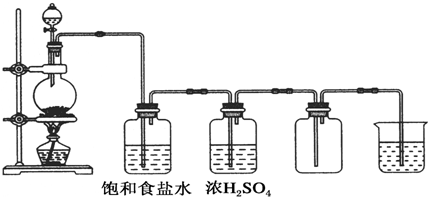
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入3滴 1mol/LFeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增多. |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2 溶液 | 两支试管中均未明显见到有 气泡产生. |
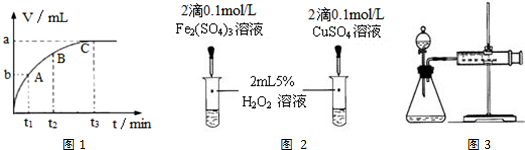
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com