
(14分)(1)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
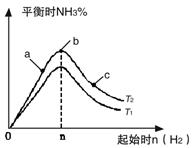
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时N2、H2的转化率均为60%,则在起始时体系中加入N2的物质的量为__________mol,此条件下(T2),反应的平衡常数K=_________,当温度升高时该平衡常数将__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
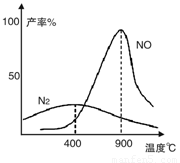
4NH3+5O2 4NO+6H2O 4NH3+3O2
4NO+6H2O 4NH3+3O2 2N2+6H2O
2N2+6H2O
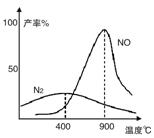
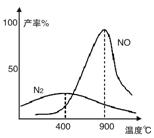
温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是___________________
(1)① c (2分) ② n/3 或1(2分);K=25/12或2.08 (2分) 减小(2分)③ 低于 (2分)
(2)N2 (2分) 氨气氧化生成NO的反应为放热反应,升高温度转化率下降 (2分)
【解析】(1)①增大氢气的浓度,平衡向正反应方向进行,氮气的转化率就越大,所以根据图像可知c点氮气的转化率最大,答案选c。
②消耗氢气是0.6×3mol=1.8mol,所以同时消耗氮气是0.6mol,因此氮气的起始物质的量是0.6mol÷60%=1mol。平衡时氢气、氮气、氨气的浓度分别是(mol/L)1.2、0.4、1.2,所以该温度下平衡常数K=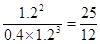 ;正反应是放热反应,升高温度,平衡向逆反应方向进行,所以平衡常数是减小的。
;正反应是放热反应,升高温度,平衡向逆反应方向进行,所以平衡常数是减小的。
③正反应是放热反应,升高温度,平衡向逆反应方向进行,氨气的含量降低,所以T2<T1。
(2)根据图像可知,温度较低时以生成的氮气为主;由于氨气氧化生成NO的反应为放热反应,升高温度,平衡向逆反应方向减小,转化率下降。


科目:高中化学 来源: 题型:
(1)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)![]() 2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
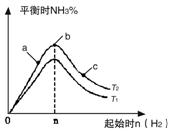
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时H2的转化率为60%,则在起始时体系中加入N2的物质的量为__________mol,此条件下(T2),反应的平衡常数K=__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
4NH3+3O2![]() 2N2+6H2O
2N2+6H2O
温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是__________。
(3)现以H2与O2、熔融盐Na2CO3组成的燃料电池(如图所示,其中Y为CO2)装置进行电解。
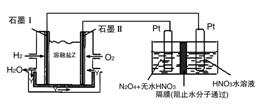
写出石墨Ⅰ电极上发生反应的电极反应式:__________。
在电解池中生成N2O5的电极反应式为:__________。
查看答案和解析>>
科目:高中化学 来源:2013届黑龙江省大庆市三十五中高三期中考试化学试卷(带解析) 题型:填空题
(14分)(1)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):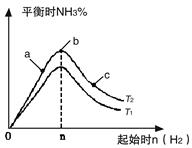
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时N2、H2的转化率均为60%,则在起始时体系中加入N2的物质的量为__________mol,此条件下(T2),反应的平衡常数K=_________,当温度升高时该平衡常数将__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):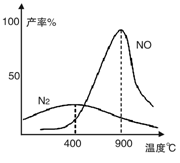
4NH3+5O2 4NO+6H2O 4NH3+3O2
4NO+6H2O 4NH3+3O2 2N2+6H2O
2N2+6H2O
温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是___________________
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省宁波市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
工业合成氨与制备硝酸一般可连续生产,流程如下:

请回答下列问题:
(1)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量,对反应N2(g)+3H2(g) 2NH3(g)
ΔH=-92.4
kJ·mol-1的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)
ΔH=-92.4
kJ·mol-1的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)

①图像中T2和T1的关系是:T2 T1(填“>”、“<”、“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,N2的转化率最高的是 (填字母)。
③要使反应后氨的百分含量最大,则在起始体系中原料投料比n(H2)/n(N2) 3(填 “>”、“<”、“=”或“无法确定”)。若容器容积恒为1 L,起始状态n(H2)=3 mol,反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。(结果保留小数点后两位)
(2)已知:N2(g)+O2(g) 2NO(g) ΔH=+180.5 kJ·mol-1
2NO(g) ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1
今有17 g氨气,假设其经催化氧化完全反应,生成一氧化氮气体和水蒸气,则该过程中所放出的热量为 kJ。
(3)在装置②中,NH3和O2从145℃就开始下列反应,在不同温度和催化剂条件下生成不同产物(如下图所示):

温度较低时生成 为主,温度高于900℃时,NO产率下降的可能原因是 。
查看答案和解析>>
科目:高中化学 来源:黑龙江省哈尔滨市2010届高三一模(理科综合)化学部分 题型:填空题
(13分)
(1)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
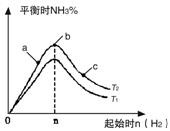
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时H2的转化率为60%,则在起始时体系中加入N2的物质的量为__________mol,此条件下(T2),反应的平衡常数K=__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
4NH3+5O2 4NO+6H2O
4NO+6H2O
4NH3+3O2 2N2+6H2O
2N2+6H2O
温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是__________。
(3)现以H2与O2、熔融盐Na2CO3组成的燃料电池(如图所示,其中Y为CO2)装置进行电解。
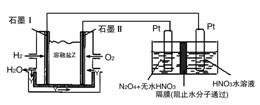
写出石墨Ⅰ电极上发生反应的电极反应式:__________。
在电解池中生成N2O5的电极反应式为:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com