
| A. | 稀释 pH=4的醋酸,溶液中c(OH-)离子的浓度降低 | |
| B. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 | |
| C. | 0.2 mol/L的盐酸与等体积水混合后pH=1 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
分析 A、稀释醋酸溶液时,溶液中c(OH-)增大;
B、pH=3的醋酸溶液,与pH=11的氢氧化钠溶液中:c(H+)=c(OH-)=1×10-3mol/L,但醋酸为弱酸,不完全电离,醋酸浓度大;
C、0.2 mol•L-1的盐酸与等体积水混合后,混合后溶液的体积是原来的2倍,所以氢离子的浓度是原来的一半;
D、硫酸是强电解质,溶液中完全电离,醋酸是弱电解质,部分电离.
解答 解:A、稀释醋酸溶液时,溶液中氢离子浓度减小,温度不变,水的离子积常数不变,则溶液中c(OH-)增大,故A错误;
B、pH=3的醋酸溶液,与pH=11的氢氧化钠溶液中:c(H+)=c(OH-)=1×10-3mol/L,但醋酸为弱酸,不完全电离,醋酸浓度大,与pH=11的氢氧化钠溶液等体积混合后,醋酸过量,溶液pH<7,故B错误;
C、0.2 mol•L-1的盐酸与等体积水混合后,混合后溶液的体积是原来的2倍,所以氢离子的浓度是原来的一半,所以与等体积水混合后c(H+)=0.1 mol/L,故C正确;
D、c(H+)=10-PH,硫酸是强电解质,氢离子完全电离出来;醋酸是弱电解质,氢离子部分电离,c(醋酸)>c(H+),所以醋酸消耗的氢氧化钠比硫酸多,故D错误.
故选C.
点评 本题考查了水的电离平衡影响因素,溶液pH计算,酸与碱混合后溶液pH的判断,其中B选项学生要注意醋酸是弱电解质,醋酸溶液中存在大量的醋酸分子,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率降低了 | ||
| C. | C为气态 | D. | C为固态或液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HI):c(H2):c(I2)=2:1:1时 | |
| B. | 温度和体积一定时,容器内压强不再变化 | |
| C. | 条件一定,混合气体的平均相对分子质量不再变化 | |
| D. | 温度和体积一定时,混合气体的颜色不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
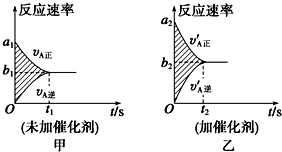
| A. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| B. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| D. | 正、逆反应速率都没有变化,平衡不发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
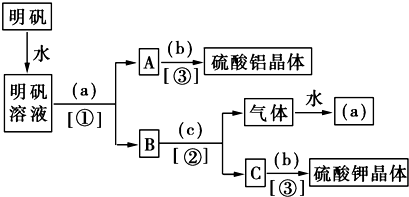
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 0 min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com