
【题目】已知金属钠的活泼性非常强,甚至在常温时能和水发生反应2Na+2H2O===2NaOH+H2↑。现将9.2克钠、7.2克镁、8.1克铝分别放入100克10.95%的盐酸中,同温同压下产生气体的质量比是( )
A. 1∶2∶3B. 4∶3∶3C. 8∶6∶9D. 1∶1∶1
【答案】B
【解析】
分别算出n(HCl)、n(Na)、n(Mg)、n(Al),钠不仅和盐酸反应还和水反应,Mg、Al和水不反应,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,都大于0.1mol,所以Mg、Al有剩余,以盐酸的物质的量计算Mg、Al生成氢气体积之比。
n(HCl)=![]() =0.3mol,n(Na)=
=0.3mol,n(Na)=![]() =0.4mol,n(Mg)=
=0.4mol,n(Mg)=![]() =0.3mol,n(Al)=
=0.3mol,n(Al)=![]() =0.3mol,钠不仅和盐酸反应还和水反应,金属钠全部反应,产生氢气的物质的量是0.2mol,Mg、Al和水不反应,根据Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑知,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,都大于0.1mol,所以Mg、Al有剩余,以盐酸的物质的量计算Mg、Al生成氢气的物质的量都是0.15mol,同温同压下产生气体的质量比等于物质的量之比,为0.2mol:0.15mol:0.15mol=4:3:3,故B正确;
=0.3mol,钠不仅和盐酸反应还和水反应,金属钠全部反应,产生氢气的物质的量是0.2mol,Mg、Al和水不反应,根据Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑知,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,都大于0.1mol,所以Mg、Al有剩余,以盐酸的物质的量计算Mg、Al生成氢气的物质的量都是0.15mol,同温同压下产生气体的质量比等于物质的量之比,为0.2mol:0.15mol:0.15mol=4:3:3,故B正确;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D均为短周期元素,它们在周期表中的位置如下图。若A原子的最外层电子数是次外层电子数的2倍。下列说法中正确的是

A. D的单质常用做半导体材料
B. 最简单气态氢化物的热稳定性:A>B
C. B的最低负化合价:-2价
D. 原子半径大小:r(C)>r(B)>r(A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数/K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有______(选填字母).
A | B | C | D | |
n(CO2)/mol | 3 | 2.4 | 3.2 | 1 |
n(H2)/mol | 2 | 1.5 | 2.5 | 1 |
n(CO)/mol | 1 | 2 | 3.5 | 0.5 |
n(H2O)/mol | 5 | 2 | 2 | 2 |
(4)在830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器A冷却水的进水口为________(填“a”或“b”)。
(2)仪器B中盛放的药品是________,其目的是________________________。
(3)实验时,装置丁中发生反应的离子方程式为______________________________,当生成6.72L的氯气(标况下),转移电子的物质的量为________。
(4)装置丙中盛放的试剂是________,若缺少装置乙,对实验造成的影响是_______________。
(5)少量硫酰氯也可用液态氯磺酸(ClSO3H)低温催化分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 +SO2Cl2,从分解产物中分离出硫酰氯的操作是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

图1
(1)写出下列物质的官能团名称:
B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

甲 乙 丙 丁
图2
①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A Na2O2 B KCl C Na2CO3 D MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质是含钠元素的单质或化合物,其中B为淡黄色固体,它们有如图所示的转化关系:
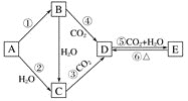
(1)推断各符号所代表的物质的化学式:
A____________,B____________,C____________,D____________,E____________。
(2)分别写出反应②、⑤的化学方程式:
②______________________________________,
⑤__________________________________________。
(3)写出反应③的离子方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com