
| A. | 已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则PM为2.5的大气一定能产生丁达尔现象 | |
| B. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| C. | ${\;}_{1}^{2}$H、${\;}_{1}^{3}$H是制造氢弹的原料,它们是同一种核素 | |
| D. | 太阳能电池可采用硅材料制作,其应用有利于环保、节能 |
分析 A.分散质的直径介于10-9m-10-7m之间的属于胶体,胶体能产生丁达尔现象;
B.大量使用农药会引起食品污染,大量使用化肥会造成土壤板结;
C.核素是指具有一定数目质子和一定数目中子的一种原子;
D.太阳能是清洁能源.
解答 解:A.分散质的直径介于10-9m-10-7m之间的属于胶体,胶体能产生丁达尔现象,所以PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则受PM2.5污染的大气不一定能产生丁达尔现象,故A错误;
B.大量使用农药会引起食品污染,大量使用化肥会造成土壤板结,且会造成环境污染,故B错误;
C.2H和3H质子数相同,中子数不同,是不同种核素,故C错误;
D.晶体硅可以制太阳能电池,利于环保、节能,故D正确.
故选D.
点评 本题主要考查胶体的性质、环境污染和核素的概念等知识,难度不大,解题中联系到平时积累的知识,所以平时要注意多积累,做题时要积极联想,和所学知识联系起来.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度 | |
| B. | 当一个可逆反应进行到平衡状态时,那么这个反应的正逆反应速率相等 | |
| C. | 平衡状态是一种静止的状态,因此反应物和生成物的浓度已经不再改变 | |
| D. | 化学反应的限度可以通过改变条件而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 蛋白质只含C、H、O、N四种元素 | |
| D. | 凡含有食品添加剂的食物对人体健康均有害,不可食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使pH试纸显蓝色的溶液中:Cu2+、Fe3+、NO3-、SO42- | |
| B. | 含有大量NO${\;}_{3}^{-}$的溶液中:NH${\;}_{4}^{+}$、I-、SO42-、H+ | |
| C. | 加入Al能放出H2的溶液中:Cl-、SO42-、NO${\;}_{3}^{-}$、Mg2+ | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、[AI(OH)4]、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
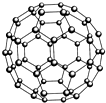 (1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取
(1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取| 元 素 | X | Y | Z |
| 电 负 性 | 1.5 | 1.2 | 1.8 |
| 第一电离能/kJ•mol-1 | 578 | 738 | 787 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数约为16NA | |
| B. | 1mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,1L庚烷所含有的分子数为$\frac{{N}_{A}}{22.4}$ | |
| D. | 26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com