
【题目】(1)氯化铵的水溶液显弱酸性,其原因为___________________(用离子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,两种酸的电离平衡常数如下表。
化学式 | CH3COOH | H2CO3 | HCN | HClO | H2SO3 |
电离常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 5×10-10 | 3.0×10-8 | K1=2×10-2 K2=1×10-7 |
①物质的量浓度均为0.1 mol/L的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由大到小的顺序为__________(用编号填写)。
②根据上表数据判断,下列离子方程式错误的是__________。
A.CO2(过量)+H2O+ClO-=HCO3-+HClO B.SO2(过量)+H2O+ClO-=HSO3-+HClO
C.CO2(少量)+H2O+CN-=HCO3-+HCN D.SO2(少量)+H2O+CN-=HSO3-+HCN
E.SO2(少量)+2CO32-+H2O=SO32-+2HCO3- F.2SO2(过量)+CO32-+H2O=2HSO3-+CO2↑
③0.10 molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
④25℃时,NaCN与HCN的混合溶液,若c(CN-)=c(HCN),则溶液中pH=__________(已知lg2=0.3,lg5=0.7)。
⑤25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中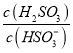 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。
【答案】 NH4++H2O![]() NH3H2O+H+ 降低 增大 b>c>d>a B D c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) 9.3 增大
NH3H2O+H+ 降低 增大 b>c>d>a B D c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) 9.3 增大
【解析】(1)氯化铵的水溶液显弱酸性是因为其中的铵根离子水解,所以方程式为:NH4++H2O![]() NH3H2O+H+。0.1 molL-1的氨水中加入少量的NH4Cl固体,因为铵根离子浓度增大,对于氨水的电离起到抑制作用,使溶液中的氢氧根离子浓度减小,溶液的pH降低。明矾电离的铝离子的水解,对于铵根离子的水解起到抑制作用,所以铵根离子的水解减少,其浓度增大。
NH3H2O+H+。0.1 molL-1的氨水中加入少量的NH4Cl固体,因为铵根离子浓度增大,对于氨水的电离起到抑制作用,使溶液中的氢氧根离子浓度减小,溶液的pH降低。明矾电离的铝离子的水解,对于铵根离子的水解起到抑制作用,所以铵根离子的水解减少,其浓度增大。
(2)①根据酸的电离平衡常数得到酸性强弱为:CH3COOH>H2CO3>HClO>HCO3-,根据越弱越水解的原理,得到碱性为:Na2CO3>NaClO>NaHCO3>CH3COONa,所以pH顺序为:b>c>d>a。
②根据酸的电离平衡常数得到酸性强弱为:H2SO3>CH3COOH>H2CO3>HSO3->HClO>HCN>HCO3-。方程式应该符合强酸制弱酸的原则。因为H2CO3>HClO,选项A正确(过量二氧化碳,保证生产碳酸氢根)。HClO有强氧化性,一定会将+价的S氧化,所以选项B错误。因为H2CO3>HCN>HCO3-,所以选项C正确(因为HCN>HCO3-,所以不能生成HCN和CO32-)。因为H2SO3>HSO3->HCN,所以选项D的反应应该得到SO32—和HCN,选项D错误。因为HSO3->HCO3-,所以通入少量SO2应该可以将碳酸根转化为碳酸氢根,本身变为SO32-,选项E正确。因为H2SO3>H2CO3>HSO3-,所以通入SO2过量应该可以将碳酸钠转化为二氧化碳,选项F正确(SO2过量,所以一定得到HSO3-)。
③0.10 molL-1Na2SO3溶液中,钠离子浓度最大,其次是亚硫酸根。亚硫酸根水解应该得到等量的亚硫酸氢根和氢氧根离子,但是亚硫酸氢根离子还要水解为亚硫酸和氢氧根离子,所以氢氧根离子浓度大于亚硫酸氢根,最后又微量氢离子,所以为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。
④HCN的电离平衡常数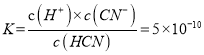 ,若c(CN-)=c(HCN),则
,若c(CN-)=c(HCN),则![]() ,pH=-lg(5×10-10)= 10-lg2 = 9.3。
,pH=-lg(5×10-10)= 10-lg2 = 9.3。
⑤向NaHSO3溶液中加入少量的I2,反应为HSO3- + I2 + H2O = SO42- + 2I- + 3H+,生成的氢离子发生如下反应:HSO3- + H+ = H2SO3,所以c(H2SO3)增大,c(HSO3-)减小,得到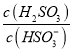 增大。
增大。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明溶液:Al3+、NH4+、Cl-、S2-
B. 中性溶液:Al3+、Fe3+、SO42-、NO3-
C. 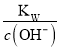 =1×10-13mol·L-1的溶液:Na+、K+、SiO32-、CO32-
=1×10-13mol·L-1的溶液:Na+、K+、SiO32-、CO32-
D. 0.1mol·L-1的NaClO溶液:Mg2+、Fe2+、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下的四种溶液(如下表):
① | ② | ③ | ④ | |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
pH =11 | pH =11 | C=0.002mol/L | C=0.002mol/L |
下列有关叙述中正确的是
A. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
B. 在④、②两种溶液等体积混合,所得溶液pH=3
C. 四种溶液由水电离出氢离子的浓度从大到小的顺序是③>①>②>④
D. 将①、④两种溶液等体积混合,溶液中c(OH-) >c(H+ )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( ) 
A. 铜棒的质量
B. 锌棒的质量
C. 氢离子的浓度
D. 硫酸根离子的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
Ⅰ.汽车尾气中的SO2可用石灰水来吸收,生成CaSO3浊液。已知常温下Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9 常温下测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=__________ 。CaSO3易变质为CaSO4,水垢中含有较多的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为:_________;
Ⅱ.已知25℃时,NH3H2O电离常数Kb=1.8×10-5,Ksp[Mg(OH)2]=1.0×10-11,向0.4mol/L的氨水中加入等体积浓度为6×10-4mol/L MgCl2 溶液,________沉淀生成(填“无”或“有”),并简述理由______;若某溶液中C(Mg2+)=1.2×10-3mol/L,需向其中加入等体积的NaOH溶液浓度为_____ mol/L时,可使Mg2+恰好沉淀完全(忽略溶液体积变化)。
Ⅲ.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
①若平衡体系的pH=2,则溶液显____________色。
②能说明第①步反应达平衡状态的是_____________。
A.Cr2O72-和CrO42-的浓度相同 B.2v (Cr2O72-) =v (CrO42-) C.溶液的颜色不变
③第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
④第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+ (aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
Cr3+ (aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 使甲基橙变黄色的溶液中:Na+、Al3+、SO42-、Cl-
B. pH=7的溶液中:K+、Na+、A1O2-、CO32-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3- 、SO42-
D.  =1X10-13mol/L的溶液中:NH4+、Ca2+、Cl-、NO3-
=1X10-13mol/L的溶液中:NH4+、Ca2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在活性炭催化下,用CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料可生成橙黄色晶体X。为测定其组成,进行如下实验。
I、氨的测定:
精确称取13.375 g X配成1000 mL溶液,取出10.00 mL溶液,注入如图所示的三颈瓶(B)中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用20.00 mL 0.20 mol·L1的标准盐酸吸收。蒸氨结束后取下接收瓶,用0.20 mol·L1NaOH标准溶液滴定过剩的HCl,到终点时消耗5.00 mLNaOH溶液。

II、氯的测定:
准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,已知:Ag2CrO4为砖红色,Ksp(Ag2CrO4)=1.12×1012。
回答下列问题:
(1)仪器a的名称是_________测定氨前应该对装置进行__________,安全管的作用原理是_____________________________________________________。
(2)NaOH标准溶液应装入___式滴定管,C装置冰盐水的作用是_________。
(3)测定氯的过程中,使用棕色滴定管的原因是____________________;判断滴定终点的方法是___________________________________________________,若终点溶液中c(Ag+)=1.0×105 mol·L1,此时c(CrO42)为______ mol·L1。
(4)13.375 g样品X中氨的物质的量为_____ mol。
(5)经测定,样品X的化学式为Co(NH3)6Cl3,写出制备X的化学方程式:_________________;X的制备过程中,若温度过高X产率下降,原因是___________________。(写一点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. 次氯酸的结构式:H—Cl—O B. 乙醇的结构简式: C2H6O
C. 硫离子的结构示意图:![]() D. 丙烷分子的球棍模型:
D. 丙烷分子的球棍模型:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com