
| A. | 1.0 L 0.5mol/L的Na2SO4水溶液中含有的氧原子数为2NA | |
| B. | 用含有0.2mo1 FeCl3的饱和溶液配制的氢氧化铁胶体中,胶粒数等于0.2NA | |
| C. | 1.0g H2O与D2O的混合物所含中子数为0.5NA | |
| D. | 标准状况下,11.2L氯气与足量铁粉充分反应,转移的电予数为NA |
分析 A.硫酸钠溶液中硫酸根离子水分子都含有氧原子;
B.胶体为多个粒子的集合体;
C.H2O与D2O含有中子数不同,且摩尔质量不同;
D.氯气与铁反应生成氯化铁,标况下11.2L氯气的物质的量为0.5mol,完全反应得到1mol电子.
解答 解:A.硫酸钠溶液中硫酸根离子水分子都含有氧原子,则1.0 L 0.5mol/L的Na2SO4水溶液中含有的氧原子数远远大于2NA,故A错误;
B.胶体为多个粒子的集合体,所以用含有0.2mo1 FeCl3的饱和溶液配制的氢氧化铁胶体中.胶粒数小于0.2NA,故B错误;
C.H2O与D2O含有中子数不同,且摩尔质量不同,所以只知道混合物质量,无法计算含有中子数多少,故C错误;
D.标准状况下,11.2L氯气物质的脸为0.5mol,与足量铁粉充分反应生成1mol氯离子,转移的电予数为NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,题目难度不大.


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①③⑤ | C. | ③④⑥ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
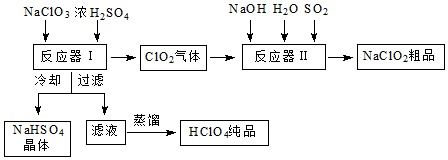
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
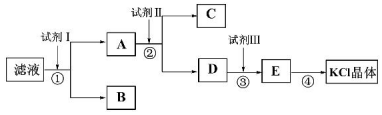
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族元素的金属性比IIA族元素的金属性强 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次增强 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA | |
| B. | 常温常压下,3.0g乙烷中含有的碳氢键数为0.07NA | |
| C. | 250mL 1 mol•L-1H2SO4溶液中含有氧原子数为NA | |
| D. | 电解精炼铜时,当阳极溶解32g铜,则转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.mol/LNaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| Ⅰ | 4.0 | 2.0 | 0 | 2.0 | 3滴 | 较快褪色 |
| Ⅱ | 4.0 | 4.0 | 0 | 0 | 3滴 | 缓慢褪色 |
| Ⅲ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
| Ⅳ | 4.0 | 0 | 2.0 | b | 3滴 | 较快褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | K+、Na+、ClO-、SO42- | 少量SO2 | SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S═2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、AlO2- | 过量铜粉 | 2Fe3++Cu═2Fe2++Cu2+ |
| D | K+、Na+、HCO3-、AlO2- | 少量HCl | H++AlO2-+H2O═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| B. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | |
| C. | 一定温度下,1molFeCl3水解生成NA个Fe(OH)3胶体颗粒 | |
| D. | 在标准状况下,2.24L苯中所含分子数约为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com